江苏省南通、扬州、连云港高三第二次调研测试化学试卷
国务院颁布的《“十二五”控制温室气体排放工作方案》提出,2015年我国单位国内生产总值CO2排放要比2010年下降17 %。下列说法不正确的是
| A.CO2属于酸性氧化物 |
| B.CO2是导致酸雨发生的主要原因 |
| C.可用Na2CO3溶液捕捉(吸收)CO2 |
| D.使用氢能源替代化石燃料可减少CO2排放 |
下列有关化学用语表示正确的是
A.过氧化钙(CaO2)的电子式: |
B.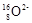 离子的结构示意图: 离子的结构示意图: |
C.H2CO3的电离方程式:H2CO3 2H++CO32- 2H++CO32- |
| D.葡萄糖的结构简式:C6H12O6 |
下列物质性质与应用对应关系正确的是
| A.浓硫酸具有脱水性,可用于干燥CO2 |
| B.氨气具有还原性,可用于检查HCl泄漏 |
| C.四氯化碳密度比水大,可用于萃取溴水中的Br2 |
| D.氧化铝具有高熔点,可用于生产耐火砖 |
用下列实验装置进行相应实验,能达到实验目的的是(夹持装置未画出)
| A.用装置甲检验溶液中是否有K+ |
| B.用装置乙制取并收集少量NH3 |
| C.用装置丙进行喷泉实验 |
| D.用装置丁加热熔融NaOH固体 |
25℃时,下列各组离子在指定溶液中一定能大量共存的是
| A.使酚酞变红色的溶液:NH4+、Ca2+、NO3-、SO42- |
| B.c(OH-)=1×10-13 mol·L-1的溶液:Na+、K+、ClO-、SO42- |
| C.0.1 mol·L-1 FeCl2溶液:K+、Na+、SO42-、NO3- |
| D.0.1 mol·L-1 KMnO4溶液:Na+、Mg2+、NO3-、SO32- |
设NA为阿伏加德罗常数的值,下列说法中正确的是
| A.常温常压下,2.24 L H2O中含有极性共价键的数目为0.2 NA |
| B.0.1 mol·L-1 NH4Cl溶液中含有NH4+的数目小于0.1 NA |
| C.100 mL 12 mol·L-1的浓HNO3与过量Cu反应转移电子的数目为0.6 NA |
| D.标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2 NA |
下列指定反应的离子方程式正确的是
| A.Na2O与水反应:O2-+H2O=2OH- |
| B.SO2使氯水褪色:SO2+Cl2+2H2O=4H++SO42-+2Cl- |
| C.Na2SiO3溶液与盐酸反应:Na2SiO3+2H+=H2SiO3↓+2Na+ |
| D.Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+2H2O |
图像能直观地反映有关物理量的变化及规律,下列各图像与描述相符的是
| A.图1表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示0.1 mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化 |
| C.图3表示分别稀释10 mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100 |
D.图4表示平衡2NO2(g) N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 |
已知X、Y、Z、W、R是原子序数依次增大的五种短周期主族元素,其中Y、R原子最外层电子数相等;X元素最低负价与W元素最高正价绝对值相等;工业上常用电解熔融氧化物的方法冶炼W单质;Z、W、R最高价氧化物对应的水化物两两反应均生成盐和水。下列说法正确的是
| A.简单离子半径:Y>Z>W |
| B.简单氢化物的热稳定性:X>Y>R |
| C.W的最高价氧化物对应的水化物碱性比Z的强 |
| D.R的最高价氧化物对应的水化物化学式一定是HRO4 |
下列说法正确的是
| A.用上图所示方法可保护钢闸门不被腐蚀 |
| B.SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 |
C.常温下,NH4Cl溶液加水稀释,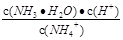 增大 增大 |
D.C(s)+H2O(g) CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 |
化合物M具有广谱抗菌活性,合成M的反应可表示如下:
下列说法正确的是
| A.X分子中有2个手性碳原子 |
| B.Y分子中所有原子可能在同一平面内 |
| C.可用FeCl3溶液或NaHCO3溶液鉴别X和Y |
| D.在NaOH溶液中,1 mol M最多可与5 mol NaOH发生反应 |
下列实验操作与预期实验目的或所得实验结论不一致的是
| 选项 |
实验操作 |
实验目的或结论 |
| A |
将Al2(SO4)3、NaOH溶液相互滴加 |
鉴别Al2(SO4)3、NaOH溶液 |
| B |
向AgCl悬浊液中滴入少量KI溶液,有黄色沉淀生成 |
说明KSP(AgCl)>KSP(AgI) |
| C |
向NaHS溶液中滴入酚酞,溶液变红色 |
HS-水解程度大于电离程度 |
| D |
向某溶液中滴加氯水,再滴加KSCN溶液,溶液变成红色 |
该溶液中一定含有Fe2+ |
25℃时,向10 mL 0.1 mol·L-1 CH3COONa溶液中加入0.1 mol·L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示。下列说法正确的是
| A.点①所示溶液中:c(OH-)=c(H+)+c(CH3COOH) |
| B.点②所示溶液中:c(CH3COOH)+c(CH3COO-)=0.05 mol·L-1 |
| C.点③所示溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| D.点④所示溶液中:c(Na+)+c(H+)<c(CH3COO-)+c(Cl-) |
在2 L的恒容密闭容器中充入A(g)和B(g),发生反应:
A(g)+B(g) 2C(g)+D(s) △H=a kJ·mol-1
2C(g)+D(s) △H=a kJ·mol-1
实验内容和结果分别如下表和下图所示。下列说法正确的是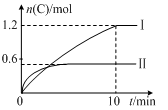
| 实验序号 |
温度 |
起始物质的量 |
热量变化 |
|
| A |
B |
|||
| Ⅰ |
600℃ |
1 mol |
3 mol |
96 kJ |
| Ⅱ |
800℃ |
1.5 mol |
0.5 mol |
—— |
A.实验Ⅰ中,10 min内平均速率v(B)=0.06 mol·L-1·min-1
B.上述方程式中a=-160
C.600 ℃时,该反应的平衡常数是0.45
D.向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率增大
硝酸铝[Al(NO3)3]是一种常用媒染剂。工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3·9H2O]的流程如下:
(1)写出反应Ⅰ的离子方程式: (任写一个)。
(2)若在实验室中完成反应Ⅱ,为避免铝的损失,需要解决的问题是 ,可采取的措施为 。
(3)上述流程中采用减压蒸发,并控制反应Ⅲ中加入的稀硝酸稍过量,其目的是 。
(4)温度高于200℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4:1),该反应的化学方程式是 。
(5)若用下图所示实验装置制取Al(NO3)3,通入水蒸气的作用是 。
罂粟碱是一种异喹啉型生物碱,其盐酸盐可用于治疗脑血栓、肢端动脉痉挛等。罂粟碱的合成方法如下:
(1)B分子中的官能团有 和 (填名称)。
(2)D→E的转化属于 反应(填反应类型)。
(3)E和F发生取代反应生成G的同时有HCl生成,则F的结构简式是 。
(4)E的同分异构体有多种,写出一种符合下列要求的异构体X的结构简式: 。
Ⅰ.含氧官能团种类与D相同。
Ⅱ.核磁共振氢谱图中有4个吸收峰。
Ⅲ.属于芳香族化合物,苯环上一取代物有两种。
(5)已知: (R、
(R、 为烃基)。根据已有知识并结合相关信息,写出以乙醇为原料制备
为烃基)。根据已有知识并结合相关信息,写出以乙醇为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:
(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是 。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是 。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式: 。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值(写出计算过程)。涉及反应如下(均未配平):
NiOOH+Fe2++H+—Ni2++Fe3++H2O Fe2++MnO4-+H+—Fe3++Mn2++H2O
将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4·5H2O)。
(1)实验测得温度对反应所得固体混合物中水溶性铜(CuSO4)的含量的影响如图所示。生产过程中应将温度控制在 左右,温度升高至一定程度后,水溶性铜含量下降的可能原因是 。
(2)下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。实验中可选用的试剂和用品:稀硫酸、3 % H2O2溶液、CuO、玻璃棒、精密pH试纸。
①实验时需用约3 %的H2O2溶液100 mL,现用市售30%(密度近似为1g•cm—3)的H2O2来配制,其具体配制方法是 。
②补充完整由反应所得固体混合物X制得纯净胆矾晶体的实验步骤:
第一步:将混合物加入过量稀硫酸,搅拌、充分反应,过滤。
第二步: 。
第三步: ,过滤。
第四步: 、冷却结晶。
第五步:过滤、洗涤,低温干燥。
(3)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为 。
氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4= kJ·mol-1。
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式: 。
②在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为: ;为抑制肼的分解,可采取的合理措施有 (任写一种)。
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
①氮化硅的化学式为 。
②a电极为电解池的 (填“阴”或“阳”)极,写出该电极的电极反应式: ;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是 。
【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
X、Y、Z、M为前四周期中除氢以外原子序数依次增大的四种元素,X基态原子未成对电子数在所处周期中最多;Y元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和;Z的单质常温下为淡黄色固体,ZY3分子呈平面正三角形;M原子外围电子排布式为3dn4sn。
请回答下列问题:
(1)X、Y、Z三种元素原子第一电离能由大到小的顺序是 。(用元素符号表示)
(2)某X氢化物分子结构式为:H-X=X-H,该分子中X原子的杂化方式是 ;Y元素简单氢化物的沸点高于Z的氢化物,主要原因是 。
(3)根据等电子原理,写出X2Y分子的电子式: 。
(4)M晶体的原子堆积方式为六方堆积(如图所示),则晶体中M原子配位数是 。某M配合物化学式是[M(H2O)5Cl]Cl2·H2O,1 mol该配合物中含配位键的数目是 。
B.[实验化学]卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化。某实验小组通过如下实验对卷心菜中维生素C的含量进行测定。
第一步:配制维生素C标准溶液。将5片100 mg的维生素C药片碾碎、溶解,配成250 mL标准溶液。
第二步:制取卷心菜汁。取50 g新鲜的卷心菜,捣烂,加水充分搅拌,用下图所示装置抽滤制得卷心菜汁50 mL。
第三步:标准溶液中维生素C含量的测定。移取20.00 mL维生素C标准溶液于锥形瓶中,加入1 mL 0.1 mol·L-1盐酸酸化,加入2滴淀粉试液作指示剂,用0.010 mol·L-1碘水滴定到终点,记录消耗碘水的体积。重复上述操作两次,消耗碘水的平均体积为V1。
第四步:卷心菜汁中维生素C含量的测定。移取20 mL卷心菜汁于锥形瓶中,加入1 mL 0.1 mol·L-1盐酸酸化,加入2滴淀粉试液作指示剂,用0.010 mol·L-1碘水滴定到终点,记录消耗碘水的体积。重复上述操作两次,消耗碘水的平均体积为V2。
(1)与过滤相比,抽滤的优点是 。抽滤所用的滤纸应略 (填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。
(2)移取20.00 mL待测液选用的仪器是 ,滴定终点溶液的颜色呈 色。
(3)上述滴定过程滴定速度要快,否则将会使测得的维生素C的含量偏低,其可能的原因是 。
(4)1kg卷心菜中所含维生素C相当于 片上述维生素药片。(用含V1、V2的代数式表示)

 粤公网安备 44130202000953号
粤公网安备 44130202000953号