下列离子的检验方法正确的是
A.某溶液 有白色沉淀,说明原溶液中有Cl- 有白色沉淀,说明原溶液中有Cl- |
B.某溶液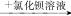 有白色沉淀,说明原溶液中有SO42- 有白色沉淀,说明原溶液中有SO42- |
C.某溶液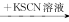 无明显变化 无明显变化 溶液变红色,说明原溶液中有Fe2+ 溶液变红色,说明原溶液中有Fe2+ |
D.某溶液 生成无色无味气体,说明原溶液中有CO32- 生成无色无味气体,说明原溶液中有CO32- |
铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
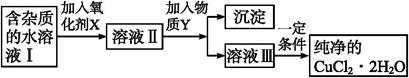
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| |
Fe3+ |
Fe2+ |
Cu2+ |
| 氢氧化物开始沉淀时的pH |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀时的pH |
3.2 |
9.0 |
6.7 |
请回答下列问题:
(1)得到溶液II,需加入氧化剂X, 最适合作氧化剂X的是 (填编号,否则不给分)。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入氧化剂X的目的是 。
(3)为了除去Fe3+,需加入物质Y调节溶液的PH值为
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体? (填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。
(5)已知Fe(OH)3的Ksp=1×10-35mol4/L4;若Fe3+沉淀完全时,在溶液中Fe3+的浓度为1×10-5mol/L,则此时溶液的pH最小为 .
只用一种试剂就可将AgNO3、KSCN和H2SO4、NaOH四种无色溶液区分,这种试剂
是
| A.Fe(NO3)3溶液 | B.FeCl2溶液 | C.BaCl2溶液 | D.FeCl3溶液 |
完成下列实验所选择的装置或仪器不正确的是
| |
A |
B |
C |
D |
| 实验 |
分离水和酒精 |
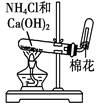
用铵盐和碱制取NH3 |
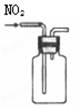
用排空气法收集NO2 |
用自来水制取蒸馏水 |
| 装置 或 仪器 |
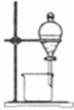 |
 |
 |
 |
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
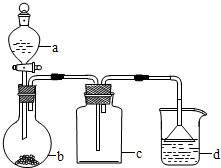
| 选项 |
a中的物质 |
b中的物质 |
c中收集的气体 |
d中的物质 |
| A |
浓氨水 |
CaO |
NH3 |
H2O |
| B |
浓硫酸 |
Na2SO3 |
SO2 |
NaOH溶液 |
| C |
稀硝酸 |
Cu |
NO2 |
H2O |
| D |
饱和食盐水 |
MnO2 |
Cl2 |
NaOH溶液 |
硫酸亚铁晶体(FeSO4•7H2O)在医药上常作补血剂,某课外研究小组测定该补血剂中铁元素的含量,其实验步骤如下:

请回答下列问题:
(1)证明操作Ⅰ滤液中含有Fe2+的方法之一是向滤液中加入NaOH溶液,现象为 ,步骤Ⅱ中发生反应的离子方程式为 .
(2)写出步骤Ⅳ中一系列处理的操作步骤:过滤、 、灼烧、 、称量.
(3)若实验无损耗,则每片补血剂中含铁元素 g.
(4)该小组有些同学认为用酸性KMnO4溶液滴定也能进行铁元素含量的测定.
①该实验原理用离子方程式可表示为 .
②实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 .
③该实验中的KMnO4溶液需要酸化,用于酸化的酸是 .
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
④若取m g该补血剂用0.1mol•L﹣1的KMnO4溶液进行滴定,在此实验过程中共用去KMnO4溶液100mL,则该补血剂中铁元素的质量分数为 .
只用一种试剂可以区别Na2SO4、MgCl2、FeCl2、A12(SO4)3、CuSO4五种溶液,这种试剂是
| A.氨水 | B.NaOH溶液 | C.硫酸 | D.NaNO3溶液 |
纯碱和小苏打都是白色晶体,在日常生活中都可以找到.若要在家中将它们区分开来,下面的方法中可行的是
| A.分别放在炒锅中加热,观察是否有残留物 |
| B.分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧,观察火焰颜色 |
| C.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀 |
| D.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度 |
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
| A.分液、萃取、蒸馏 | B.萃取、蒸馏、分液 |
| C.分液、蒸馏、萃取 | D.蒸馏、萃取、分液 |
对于某些离子的检验及结论一定正确的是( )
| A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是( )
| A.KSCN | B.BaCl2 | C.NaOH | D.HCl |
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置:
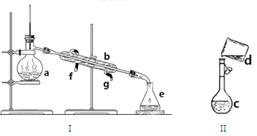
(1)写出下列仪器的名称:A. B. C.___________
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,将仪器补充完整后进行实验,温度计水银球的位置在 处。冷凝水的进出方向为 。
(3)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。除了图中给出的的仪器和托盘天平外,为完成实验还需的仪器有: 。
②根据计算得知,所需NaOH的质量为 g