银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为 ;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)完成煅烧过程中一个反应的化学方程式: CuO+ Al2O3 CuAlO2 + ↑。
CuAlO2 + ↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0mol•L—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是 、过滤、洗涤和干燥。
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
(1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是:
+ ClO3—+ = MnO2↓+ Cl2↑+ 。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、 、 、玻璃棒。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0、224LCO2(标准状况下),则在第①步反应中至少需要 mol H2SO4。
(已知摩尔质量:MnO2 -87g/mol; MnO-71g/mol; MnCO3-115 g/mol)
已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:
①A + B→白色沉淀,加入稀硝酸,沉淀不溶解
②B + D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色
③C + D→白色沉淀,继续加入D溶液,白色沉淀逐渐消失
(1)试推断A B C D (化学式)。
(2)写出下列反应的化学方程式或离子方程式:
①实验②中沉淀由白色转化为红褐色的化学方程式 ,
②C溶液与D溶液反应后生成的白色沉淀溶解于D溶液中的离子方程式 。
海水是巨大的资源宝库,从海水中提取食盐和溴过程如下:
(1)将NaCl溶液进行电解,在电解槽中可直接得到的新产品有H2、____、____或H2、_____。
(2)步骤Ⅱ中用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_______。
(3)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
请你参与分析讨论:
①实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件_______。
②C中液体产物颜色为_______,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是_______。
③用离子方程式解释NaOH浓溶液的作用 。
废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法可回收WC和Co。工艺流程简图如下:

⑴电解时废旧刀具做阳极,不锈钢做阴极,HCl溶液为电解液。阴极主要的电极反应式为 。
⑵净化步骤所得滤饼的主要成分是 。回收的洗涤液代替水配制电解液,目的是回收利用其中的 。
⑶溶液I的主要成分是 。洗涤CoC2O4不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是 。
⑷将Co2O3还原成Co粉的化学反应方程式为 。
(1)滑石一种硅酸盐矿物,其化学式为Mg3Si4O10(OH)2,用氧化物的形式表示为 。
(2)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂。
①Fe2O3(Al2O3) ②NO(NO2)
③Cl2 (HCl) ④FeCl3 (FeCl2)
(3)用铝箔包裹0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到标准状况下气体的体积是_________(填字母序号)
a.1.12L b.>1.12L c.<1.12L
以下是25℃时几种难溶电解质的溶解度:
| 难溶电解质 |
Mg(OH) 2 |
Cu(OH) 2 |
Fe(OH) 2 |
Fe(OH) 3 |
| 溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子,例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为____________(填化学式)而除去.
(2)①中加入的试剂应该选择________为宜,其原因是_________________.
(3)②中除去Fe3+所发生的总反应的离子方程式为_____________________.
(4)下列与方案③相关的叙述中,正确的是________(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
某地煤矸石经预处理后含SiO2、Al2O3、Fe2O3,一种综合利用煤矸石制取绿矾(FeSO4·7H2O)的工艺流程如下图所示。
(1)过滤操作需要用到的玻璃仪器除了烧杯、玻璃棒还有_____________。
(2)写出所选试剂X、Y的化学式:X_______________,Y_____________。
(3)滤液B中含的阴离子有_____________(写离子符号)。
(4)滤渣SiO2可制取木材防火剂,该防火剂的化学式为______________。
(5)由溶液D转化为溶液E的离子方程式为:______________。
(6)根据图中数据,计算出原40g煤矸石中Fe2O3的质量分数为_____________。(假设适量均为恰好反应)
现有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3、Na2SO4现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀产生:
②向①的悬浊液中加入过量稀盐酸,白色沉淀部分溶解,并有气泡放出:
③取少量②的上层清液滴入硝酸银溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题:
(1)判断原白色粉末中肯定含有, ,可能含有 。
(2)写出上述实验中一定发生的有关反应的离子反应方程式: 。
Ⅰ.现有Al3+、NH4+、CO32—、HCO3— 等离子,回答下例问题:
①在强酸性条件下能够存在的离子是 ;
②在强碱性条件下能够存在的离子是 ;
③在强酸性和强碱性条件下都不能存在的离子是 。
Ⅱ.由Na+、NH4+、 Ba2+、 Cu2+、 OH—、 Fe3+、 SO42—、 Cl— 等八种离子中的六种两两组成的A、B、C三种化合物(它们不含有共同离子,已知NH4+与OH— 反应有碱性气体生成)。
A.A、B、C均易溶于水,形成无色溶液;
B.将A、B、C三种物质的溶液相互作用时,发现A与B混合后产生有刺激性气味的气体,此气体使湿润红色石蕊试纸变蓝,B与C混合产生白色沉淀,则:
①A、B、C的化学式为:
A、 ;
B、 ;
C、 。
②B+C反应的离子方程式为: 。
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。现有一红色粉末可能含有Fe2O3和Cu2O中的一种或两种,设计合理的实验探究样品中Fe2O3、Cu2O的存在。
查阅数据知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
请完成以下实验探究过程:
(一)提出假设
假设1:红色粉末是Fe2O3;
假设2:红色粉末是__________________;
假设3:红色粉末是___________________。
(二)设计实验方案
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是_________________________。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?______________。简述你的理由________________________。
(3)若固体粉末完全溶解,向所得溶液中滴加KSCN 试剂时溶液不变红色,则证明原固体粉末是_______________。写出实验过程中发生反应的离子方程式________________、_______________、__________________。
(4)若经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为_______。
某强酸性溶液中可能存在Al3+、Fe2+、NH4+、Ba2+、Cl﹣、CO32﹣、SO42﹣、NO3﹣中的若干种,现取适量溶液进行如下实验
下列有关判断正确的是
A.原溶液中一定有Fe2+、SO42﹣、H+、NH4+、Al3+
B.原溶液中一定没有Ba2+、CO32﹣、NO3﹣
C.步骤③中反应的离子方程式为2AlO2﹣+CO2+3H2O=2Al(OH)3↓+CO32﹣
D.气体A、B之间肯定不能发生反应
ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:
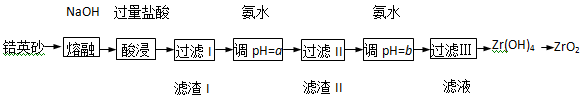
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
| 金属离子 |
Fe3+ |
Al3+ |
ZrO2+ |
| 开始沉淀时pH |
1.9 |
3.3 |
6.2 |
| 沉淀完全时pH |
3.2 |
5.2 |
8.0 |
(1)熔融时ZrSiO4发生反应的化学方程式为 ,滤渣I的化学式为 。
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是 ;继续加氨水至pH=b时,所发生反应的离子方程式为 。
(3)向过滤III所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为 。
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是 。
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式为___________。
(2)试用下图中所列各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号):________→______→_______→_________。
(3)实验室可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是________,B瓶溶液的作用是__________,C瓶溶液的作用是___________。
(4)装置②中所加的固体药品是________,可确证的产物是_________,确定装置②在整套装置中位置的理由是__________。
(5)装置③中所盛溶液是__________,可验证的产物是____________。
2012年3月21 日是第二十届“世界水日”,保护水资源,从我做起!
(1)ClO2和Cl2(还原产物都为Cl-)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的________倍。
(2)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3—、CO32—、SO42—离子中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关现象如下图所示:

请根据上图回答下列问题:
①实验中需配制1.0 mol/L的NaOH溶液100 mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为_________________________________________。
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为____________________。
③试确定NO3—是否存在?________(填“存在”、“不存在”或“不确定”),若存在,试计算c(NO3—)=________(若不存在,此问不必作答)。