已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大。G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体;在元素周期表中Z元素位于第11列。
回答下列问题:
(1)Z的核外外围电子排布式是____________________________________________。
(2)X以及与X左右相邻的两种元素,其第一电离能由小到大的顺序为____________(填元素符号)。
(3)QR2分子中,Q原子采取________杂化,写出与QR2互为等电子体的一种分子的化学式:____________。
(4)分子式为G 2R、G 2Y的两种物质中一种更稳定,原因是_____________;T的氯化物的熔点比Q的氯化物的熔点高,原因是___________________。
(5)据报道,由Q、X、Z三种元素形成的一种晶体具有超导性,其晶体结构如下图所示。晶体中距每个X原子周围距离最近的Q原子有______个。
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)Se原子中电子占据的最高能层符号是________,该能层具有的原子轨道数为 ,其核外M层电子的排布式为________;
(2)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是________;
(3)H2Se的酸性比H2S________(填“强”或“弱”)。气态SeO3分子的立体构型为________,SO42-离子的立体构型为________;
(4)含氧酸可表示为:(HO)mROn,酸的强度与酸中的非羟基氧原子数n有关,n越大,酸性越强。一般n="0" 弱酸,n="1" 中强酸,n=2强酸,n="3" 超强酸。
据实验事实可知硼酸(H3BO3)是一元弱酸,而亚磷酸是中强酸(H3PO3)
①写出硼酸(H3BO3)的电离方程式 。
②写出亚磷酸与过量的NaOH反应的化学方程式 。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,ZnS的密度为d g·cm-3,则其晶胞中a位置S2-离子与b位置Zn2+离子之间的距离为________pm(列式表示)。
氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是 。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4的结构式为 。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g)
若该反应中有4mol N-H键断裂,则形成的π键有 mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4与硫酸铵晶体类型相同,则N2H6SO4的晶体内不存在 。
A.离子键 B.共价键 C.配位键 D.范德华力
(3)FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是 。KSCN中的阴离子与CO2互为等电子体,该阴离子的电子式是 。
(4)美国科学家合成了结构呈“V”形对称的N5+,已知该离子中各原子均达到8电子稳定结构。则有关该离子的下列说法中正确的是 。
A.每个N5+中含有35个质子和36个电子
B.该离子中有非极性键和配位键
C.该离子中含有2个π键
D.与PCl4+互为等电子体
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。
下列分子或离子中,能被该有机化合物识别的是_________(填标号)。
a.CF4 b.CH4 c.NH4+ d.H2O
(6)N的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子的构型为 形,阳离子中氮的杂化方式为 。
原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,E2+核外电子有18种运动状态,F+的三个能层电子全充满。下表是主要化合价及原子半径数据:
| |
A |
B |
C |
D |
E |
F |
| 主要化合价 |
-1 |
-3 +5 |
-2 +6 |
-1 +7 |
+2 |
+1 +2 |
| 原子半径 |
0.071 |
0.11 |
0.102 |
0.099 |
0.197 |
0.117 |
(1)B、C、D三种元素第一电离能数值由小到大的顺序是 (填元素符号);
(2)F2+与NH3 形成配离子的结构式为 ;该配离子具有对称的空间构型,其中两个NH3被两个Cl-取代,能得到两种不同结构的产物,则该配离子的空间构型为 。往某种蓝色溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,可得到含有上述配离子的配合物。写出沉淀溶解的离子方程式 。
(3)A 、E两种元素形成晶体晶胞是下图中的 (填①、②、③或④);
(4)下图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,请选出A的氢化物所在的折线 (填n、m、x或y)。
由Cu、N、B、Ni等元素组成的新型材料有着广泛用途。
(1)基态Cu+的最外层核外电子排布式为_________。
(2)研究者预想合成一个纯粹由氮组成的新物种N5+N3-,若N5+中每个氮原子均满足8电子结构,以下有关N5+推测正确的是 。
A.N5+有24个电子
B.N5+离子中存在三对未成键的电子对
C.N5+阳离子中存在两个氮氮三键
(3)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3。通过3CH4 +2(HB=NH)3+6H2O ==3CO2+6H3BNH3制得。
①与上述化学方程式有关的叙述不正确的是_________。(填标号)
A.反应前后碳原子的轨道杂化类型不变
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形
C.第一电离能:N>O>C>B
D.化合物A中存在配位键
②1个(HB=NH)3分子中有_________个σ键。
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为_________。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________。
(5) NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶体中距离最近的两个阳离子核间的距离为_________(用含有a的代数式表示)。在一定温度下,NiO晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为_________g(氧离子的半径为1. 40×10 m,
m, ≈l. 732)。
≈l. 732)。
(10分) 纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
①某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了 。
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为 。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由 。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。
③继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
X、Y、T、Q 四种元素,位于元素周期表前四周期,元素的性质或结构信息见下表。
| 元素 |
性质或结构信息 |
| X |
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。 |
| Y |
二价阳离子的外围电子层排布为3d9 |
| T |
原子核外s轨道电子总数等于p轨道电子总数;人体内含量最多的元素,且其单质是常见的助燃剂。 |
| Q |
第三周期主族元素中原子半径最小。 |
请根据上述信息回答下列问题:
(1)写出 X3- 的一种等电子体的化学式 ;X的气态氢化物易液化的原因: 。
(2)写出T元素基态原子的核外电子排布图 ;Q元素的原子核外有 种运动状态不同的电子。
(3)元素 X 、T 的电负性相比, 的小(填元素名称);元素 X 的第一电离能与T相比较,T的 (填“大”或“小”)。
(4)甲醛(CH2O)分子中σ 键与π 键的个数之比为 。
(5)Y元素在周期表中位于 区。Y单质晶体的晶胞如图所示,该晶胞中实际拥有 个原子,该晶体中Y原子在三维空间里的堆积方式为 堆积。
(6)在Y的硫酸盐溶液中通入X的气态氢化物至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。此蓝色沉淀溶解的离子方程式为: 。
(7)元素X与Q可形成化合物XQ3,根据价层电子对互斥理论判断XQ3的空间构型为: ,分子中X原子的杂化方式为 杂化。
含碳物质具有许多优良性质。
(一)2010年诺贝尔物理学奖所指向的是碳的又一张奇妙脸孔:人类已知的最薄材料——石墨烯。
(1)下列说法中,正确的是 。
A.固态时,碳的各种单质的晶体类型相同
B.石墨烯只含有非极性键
C.从石墨剥离得石墨烯需要破坏化学键
D.石墨烯具有导电性
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜等或合金,含碳源可以是乙炔、苯、乙醇等中的一种或任意组合。
①乙醇和二甲醚(H3C—O—CH3)是同分异构体,二甲醚的沸点比乙醇 (填“高”或“低”),原因是 。
②铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是 。
(二)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
(3)已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为 145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确,并阐述理由 。
(4)科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。
(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 ,Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
( 9分)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1 821 |
15 390 |
21 771 |
| B |
738 |
1 451 |
7 733 |
10 540 |
①某同学根据上述信息,某同学推断B的核外电子排布如图所示,该同学所画的电子排布图违背了________。
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为____________。A原子杂化类型是_______________。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C—C的键长为154.45 pm,C60中C—C键长为145~140 pm,有同学据此认识C60的熔点高于金刚石,你认为是否正确__________理由是____________________________。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为____________。晶胞中每个C60分子周围与之等距离且最近的C60分子数是_________。
③继C60后,科学家又合成了Si60、N60;C、Si、N原子电负性由大到小的顺序是____________。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为________。
(3)1986年,瑞士两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的Nobel物理学奖。其晶胞结构如图。
①根据图示晶胞结构,推算晶体中Y、Cu、Ba和O原子个数比,其化学式________。
②已知该化合物中各元素的化合价Y为+3价,Ba为+2价,Cu为+2价和Cu为+3价,根据①所推出的化合物的组成,试计算化合物中这两种价态Cu原子个数比_______________。
③Ba2+的配位数为___________。
本题由两小题构成,共16分。
Ⅰ、(8分)A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其他元素既不在同周期也不在同主族。B、C、D的最高价氧化物对应水化物均能互相发生反应生成盐和水。A和E可形成离子化合物,其晶胞结构如下图所示。
(1)A和E所形成化合物的电子式是__________。
(2)A、B、C、D四各元素的原子半径由小到大的顺序为__________(用元素符号表示)。
(3)A和E形成的化合物的晶体中,每个阳离子周围与它最近且距离相等的阳离子共有_________个。
(4)已知A和E所形成化合物晶体的晶胞体积为1.6×10-22 cm3,则A和E组成的离子化合物的密度为(结果保留一位小数)__________。
Ⅱ.(8分)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
M层上有2对成对电子 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
(1)元素T的原子最外层共有________种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是________。
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式________(用元素符号表示)。
(3)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z原子的价电子数比T原子多
e.Z的最高价氧化物的水化物酸性强于T的最高价氧化物的水化物
f.Z的单质能与T的氢化物水溶液发生置换反应
(4)Z有多种常见含氧酸,酸性由强到弱的顺序是________________________。
按要求回答以下问题:
(1)X、Y、Z 是短周期非金属元素,核电荷数依次增大。X原子外围电子排布为ns2np2,Z是地壳中含量最多的元素。W、Q是第四周期元素,其中Q元素的核电荷数为29。W原子核外未成对电子数在同周期中最多。
①Y元素在周期表中的位置为______________ ;其轨道表示式为_________________。
②X、Y、Z元素的第一电离能由大到小的顺序为_________________(用元素符号作答),X与Z形成三原子分子的电子式为___________(用相关的化学用语作答)。
③Y的氢化物沸点_______Z的氢化物的沸点(填“ >”“<”或 “=”)。
④基态W原子的外围电子排布式为 。
⑤Q的氢化物的晶胞结构如图所示,其化学式是 。
(2)过渡元素在生活、生产和科技等方面有广泛的用途。
①应用于合成氨反应的催化剂(铁)的表面上存在氮原子,上图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则图示铁颗粒表面上氮原子与铁原子的个数比为________。
②现代污水处理工艺中常利用聚合铁{简称PFS,化学式为[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是______。(填序号)
| 元素 |
Mn |
Fe |
| 电离能 |
|
|
| (kJ·mol-1) |
|
|
| I1 |
717 |
759 |
| I2 |
1 509 |
1561 |
| I3 |
3 248 |
2 957 |
A.PFS中铁显+3价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由上表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
③铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
晶胞中铂(Pt)原子的配位数数为为 。
选考[化学一物质结构与性质]铜是应用较为广泛的有色金属。
(1)基态铜原子的核外电子排布式为 。
(2)金属化合物Cu2Zn合金具有较高的熔点、较大的强度、硬度和耐磨度。Cu2Zn合金的晶体类型是 。
(3)某含铜化合物的离子结构如图所示。
①该离子中存在的作用力有 ;
a.离子键
b.共价键
c.配位键
d.氢键
e.范德华力
②该离子中第二周期的非金属元素的第一电离能由大到小的顺序是 ;
③该离子中N原子的杂化类型有 。
(4)铜与氧形成化合物的晶体结构如图。该化合物的化学式为 ,O的配位数是 。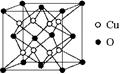
氮(N)元素与多种元素可以形成多种化合物。
(1)NH4Cl受热分解时克服的化学键有 ;NH4Cl晶体不能导电的原因是 。
(2)N、H元素除了可以形成10电子分子NH3外,还可形成18电子分子肼,肼的结构简式为NH2—NH2。若将肼分子中的2个H原子替换为甲基(—CH3),所得分子的结构简式可能为 、 。
(3)平面型BF3很容易与特定化合物[如N(CH3)3]以配位键形成四面体配位化合物,请在下图中用“→”标出B、N原子间存在的配位键。
(4)氮化硼(BN)是一种新型无机非金属材料,氮化硼有两种重要晶型A型和B型。A型氮化硼硬度很高,是特殊的耐磨和切削材料;B型氮化硼化学稳定性较好,是一种优良的润滑剂。A型氮化硼结构下图中 (选填“I”或“Ⅱ”)所示。工业上氮化硼以三氯化硼、氢气、氮气为原料,在高温条件下反应制得,写出该反应的化学方程式 。
(5)氢氧化铜与氨水形成铜氨溶液,已知[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 (选填“平面四边形”或“正四面体”)。[Cu(NH3)2]+在空气中立即转化为深蓝色的[Cu(NH3)4]2+,简述发生转化的可能原因 。
(6)向[Cu(NH3)4]SO4溶液中通入SO2至微酸性,有白色沉淀生成。该沉淀包含一种正四面体型的阳离子和一种三角锥型的阴离子,摩尔质量为162g/mol,且Cu、S、N的物质的量之比为1:1:1,则该白色沉淀的化学式为 。
【化学——选修3 物质结构与性质】选考下图为元素周期表的一部分,字母下方数值为该元素电负性,根据信息回答下列问题(用相应元素符号进行答题):
(1)b、h两元素可形成化合物bh2,写出其电子式: 。
(2)e、g两元素可形成两种化合物eg3、e2g6,eg3的分子构型为 ,eg3、e2g6中心原子e的杂化方式分别为 、 。
(3)d元素形成的单质可与g的氢化物浓溶液在加热条件下反应生成一种以二价d离子为内界中心原子(配位数为4)的配位化合物与一种可燃性气体,写出反应的化学方程式: 。
(4)f、g、h、i四种元素对应单质分子的键能如下表:
| 共价键 |
f—f |
g—g |
h—h |
i—i |
| 键能(kJ/mol) |
157 |
242.7 |
193.7 |
152.7 |
试从原子半径角度阐述f—f键键能反常的原因: 。
(5)c元素的元素符号是 ,价电子排布式为 ,下图是
一种受到较多关注的c元素单质与金属镧(La)形成的储氢材料的结构示意图,请在图中勾画出该晶体的一个晶胞。计算出该合金的化学式为: 。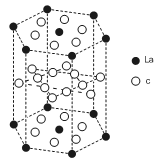
[化学——选修3:物质结构与性质] 周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子。请填写下列空白。
(1)e元素基态原子的核外电子排布式为____________。
(2)b、c、d三种元素的第一电离能数值由小到大的顺序为____________(填元素符号),其原因是__________________。
(3)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;分子中既含有极性共价键,又含有非极性共价键的化合物是 (填化学式,写出两种)。
(4)已知c、e能形成晶胞如图甲和图乙所示的两种化合物,化合物的化学式为分别为:甲________,乙 ;甲高温易转化为乙的原因是__________________。
(5)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图丙所示)。该化合物中,阴离子为 ,该化合物加热时首先失去的组分是 ,判断理由是 。