福建省宁德市普通高中高三毕业班5月质检化学试卷
化学与生产、生活密切相关,下列说法正确的是
| A.玻璃钢是钢与玻璃纤维形成的复合材料 |
| B.氮氧化物是形成光化学烟雾和酸雨的一个重要原因 |
| C.石油化工废弃物易造成水体富营养化 |
| D.硫酸铵是常用的一种硝态氮肥 |
下列说法正确的是
| A.米酒密封储存变香的过程涉及取代反应 |
| B.甲烷、氯乙烯和硝基苯都属于烃类 |
| C.有机化合物均易燃烧 |
| D.糖类、脂肪和蛋白质在一定条件下都能发生水解反应 |
短周期主族元素X、Y、Z的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物。常温下,Z的单质能溶于X的最高价氧化物水化物的稀溶液,不溶于其浓溶液。下列说法正确的是
| A.元素Y的最高正化合价为+6 |
| B.简单离子半径的大小顺序:X>Y>Z |
| C.简单气态氢化物的稳定性:X>Y |
| D.元素X和Y能形成离子化合物 |
利用下图所示装置进行实验,通入Cl2前装置Ⅰ中溶液呈红色。下列说法不合理的是
| A.通入Cl2后,装置Ⅰ中发生了氧化还原反应 |
| B.Cl2与Na2SO3溶液反应的离子方程式是:SO32-+Cl2+H2O=SO42-+2Cl-+2H+ |
| C.通入Cl2后,装置Ⅰ中溶液不褪色 |
| D.装置Ⅱ的作用是吸收尾气,防止污染空气 |
常温下,0.01 mol·L-1 NaHY(酸式盐,Y表示原子或原子团)溶液,下列说法正确的是
| A.溶液一定呈酸性 |
B.溶液中一定存在:Y2-+H2O OH-+HY- OH-+HY- |
| C.溶液加水稀释,离子浓度都减小 |
| D.溶液中:c(Na+)≥c(Y2-) |
以二氧化碳和氢气为原料制取乙醇的反应为:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) △H<0
CH3CH2OH(g)+3H2O(g) △H<0
某压强下的密闭容器中,按CO2和H2的物质的量比为1︰3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示。下列说法正确的是
| A.a点的平衡常数小于b点 |
| B.b点,v正(CO2)=v逆(H2O) |
| C.a点,H2和H2O物质的量相等 |
| D.其他条件恒定,充入更多H2,v(CO2)不变 |
电解降解法可用于治理水体硝酸盐污染,将NO3-降解成N2的电解装置如下图所示。下列说法正确的是
| A.电源的正极为b |
| B.电解时H+从膜右侧迁移到膜左侧 |
| C.Ag – Pt电极反应为:2H2O-4e-=4H++O2↑ |
| D.若转移的电子数为1.204×1024,生成N2 5.6 g |
甲、乙、丙是都含有同一种元素的不同物质,转化关系如下图:
(1)若甲是CO2。
①常用于泡沫灭火器的是 (填“乙”或“丙”,下同)。
②浓度均为0.01 mol·L-1的乙溶液和丙溶液中,水的电离程度较大的是 。
(2)若甲是Al。
①Al的原子结构示意图为 。
②当n(Al)︰n(NaOH)︰n(H2SO4)=1︰1︰2时,丙的化学式是 。
(3)若甲是Cl2。
①甲转化为乙的离子方程式是 。
②已知:TiO2(s)+2Cl2 (g)+2C(s)=TiCl4(l)+2CO(g) △H=-81 kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1
写出TiO2和Cl2反应生成TiCl4和O2的热化学方程式: 。
③常温下,将a mol·L-1乙溶液和0.01 mol·L-1H2SO4溶液等体积混合生成丙,溶液呈中性,则丙的电离平衡常数Ka= (用含a的代数式表示)。
水是重要的自然资源,与人类的发展密切相关。
(1)25℃时,水能按下列方式电离:
H2O+H2O H3O++OH- K1=1.0×10-14
H3O++OH- K1=1.0×10-14
OH-+H2O H3O++O2- K2=1.0×10-36
H3O++O2- K2=1.0×10-36
水中c(O2-) = mol·L-1(填数值)。
(2)水广泛应用于化学反应。将干燥的碘粉与铝粉混合未见反应,滴加一滴水后升起紫色的碘蒸气,最后得到白色固体。有关该实验的解释合理的是 。
| A.加水使碘和铝粉形成溶液 | B.水作氧化剂 |
| C.碘粉与铝粉反应是放热反应 | D.水作催化剂 |
(3)铁酸铜(CuFe2O4)是很有前景的热化学循环分解水制氢的材料。
ⅰ.某课外小组制备铁酸铜(CuFe2O4)的流程如下: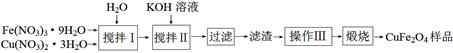
搅拌Ⅰ所得溶液中Fe(NO3)3、Cu(NO3)2的物质的量浓度分别为2.6 mol·L-1、 1.3 mol·L-1。
①搅拌Ⅰ所得溶液中Fe元素的存在形式有Fe3+和 (填化学式)。
②搅拌Ⅱ要跟踪操作过程的pH变化。在滴加KOH溶液至pH=4的过程中(假设溶液体积不变),小组同学绘制溶液中c(Fe3+)、c(Cu2+)随pH变化的曲线如下图,其中正确的是 (用“A”、“B”填空)。
(已知:Ksp[Fe(OH)3]=2.6×10-39、Ksp[Cu(OH)2]=2.2×10-20)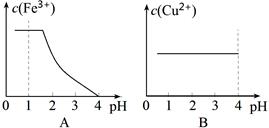
③操作Ⅲ为 、 。
ⅱ.在热化学循环分解水制氢的过程中,铁酸铜(CuFe2O4)先要煅烧成氧缺位体(CuFe2O4-a),氧缺位值(a)越大,活性越高,制氢越容易。
④氧缺位体与水反应制氢的化学方程式为 。
⑤课外小组将铁酸铜样品在N2的气氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,则氧缺位值(a)= 。
为研究亚氯酸钠(NaClO2)吸收SO2的利用率,某课外小组设计如下图所示实验(加热和夹持装置略去)。
(1)甲装置中发生反应的化学方程式为 。
(2)当观察到丙装置中 时(填现象),停止实验。
(3)探究亚氯酸钠与SO2的反应。
①假设SO2被完全反应,检验乙装置中生成的SO42-和C1-,应选用的试剂是 (酸性条件下ClO2-不干扰检验)。
a.稀硝酸
b.稀盐酸
c.BaCl2溶液
d.Ba(NO3)2溶液
e.AgNO3溶液
②完成乙装置中反应的离子方程式:
(4)测定亚氯酸钠的利用率。实验步骤如下:
ⅰ 将乙装置中溶液取出,加入过量KI晶体,再滴入适量稀硫酸,充分反应(ClO2-+4I-+4H+=2H2O+2I2+C1-)。
ⅱ 将步骤ⅰ所得溶液稀释至100. 00mL,取25.00 mL于锥形瓶中,滴入1~2滴淀粉溶液,用0.500 mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-)。重复进行3次滴定,得Na2S2O3溶液体积的平均值为20.00 mL。
①步骤ⅱ中将溶液稀释至100.00mL,需要用到的玻璃仪器有烧杯、玻璃棒、 、 。
②该实验NaClO2的利用率为 。
(5)实验结束后,课外小组同学经讨论认为:增大SO2的溶解量,有利于提高NaClO2的利用率。增大SO2的溶解量的措施有 (填一种)。
选考[化学一物质结构与性质]铜是应用较为广泛的有色金属。
(1)基态铜原子的核外电子排布式为 。
(2)金属化合物Cu2Zn合金具有较高的熔点、较大的强度、硬度和耐磨度。Cu2Zn合金的晶体类型是 。
(3)某含铜化合物的离子结构如图所示。
①该离子中存在的作用力有 ;
a.离子键
b.共价键
c.配位键
d.氢键
e.范德华力
②该离子中第二周期的非金属元素的第一电离能由大到小的顺序是 ;
③该离子中N原子的杂化类型有 。
(4)铜与氧形成化合物的晶体结构如图。该化合物的化学式为 ,O的配位数是 。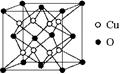
选考[化学——有机化学基础]M是一种重要材料的中间体,结构简式为: 。合成M的一种途径如下:
。合成M的一种途径如下:
A~F分别代表一种有机化合物,合成路线中的部分产物及反应条件已略去。
已知:①Y的核磁共振氢谱只有1种峰;
②RCH=CH2  RCH2CH2OH;
RCH2CH2OH;
③两个羟基连接在同一个碳原子上不稳定,易脱水。
请回答下列问题:
(1)D中官能团的名称是 ,Y的结构简式是 。
(2)步骤①的反应类型是 。
(3)下列说法不正确的是 。
a.A和E都能发生氧化反应 b.1 molB完全燃烧需6 mol O2
c.C能与新制氢氧化铜悬浊液反应 d.1 molF最多能与3 mol H2反应
(4)步骤⑦的化学反应方程式是 。
(5)M经催化氧化得到X(C11H12O4),X的同分异构体中同时满足下列条件的结构简式为 。
a.苯环上只有两个取代基,苯环上的一氯代物有2种
b.水解只生成芳香醇和二元酸,且二元酸的核磁共振氢谱只有2种峰
 粤公网安备 44130202000953号
粤公网安备 44130202000953号