汽车尾气中二氧化硫、氮氧化物和可吸入颗粒物是雾霾主要组成。某课题组用汽车尾气为原料探究二氧化硫、氮氧化物的化学性质。
I.汽车尾气(含有烃类、CO、SO2与NO等物质),冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
写出一氧化碳与一氧化氮反应的化学方程式:
II.课题组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如下图实验装置。请回答:

(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为 ;C中反应的离子方程式为 。
(2)为了实现绿色环保的目标,制取SO2装置最好选择 。(A1或A2装置)
用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。请回答:
(3)氨水吸收过量SO2的反应的离子方程式为 。
(4)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。 现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 |
预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量。 |
若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 。 步骤3: |
|
某实验小组用下列装置进行乙醇催化氧化的实验.

(1)实验中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式: .
不断鼓入空气,熄灭酒精灯,反应仍能继续,说明乙醇的氧化应是 反应.
(2)甲和乙两个水浴作用不相同.甲的作用是 ;乙的作用是 .
(3)反应进行一段时后,试管a中能收集到不同的物质,它们是 .集气瓶中收集到的气体的主要成分是 .
(4)若试管a中收集到的液用紫色石蕊试纸检验,试纸显红色,说明液体中还有 .
要除去该物质,可先在混合液中加入 (填写字母).
a.氯化钠溶液 b.苯
c.碳酸氢钠溶液 d.四氯化碳
然后,再通过 (填实验操作名称)即可除去.
为探究生活中两种常见的有机物的性质,某同学设计如下实验,请根据题目要求填写下列空格:
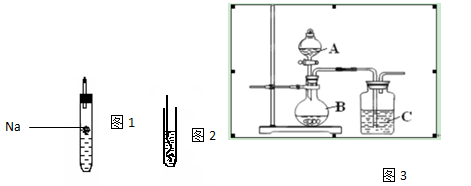
(I)如上图1所示,试管中装乙醇,(图示不一定准确)则反应现象为 ;
(II)如上图2所示,把加热的铜丝插入到装有乙醇的试管中,闻到有刺激性气味,该反应中产生的有机物为 ;(填结构简式);
(III)为了确认乙酸、碳酸和硅酸的酸性强弱,有人设计用如图3所示装置来进行实验验证。
①A中所盛试剂为___ ____。
②C中实验现象为 ,由实验可知这三种酸的酸性大小为 。
③该装置中存在不妥之处,请提出改正措施 。
甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
| 操 作 |
现 象 |
 |
I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
(1)B中反应的离子方程式是 。
(2)A中溶液变红的原因是 。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象II的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为  。
。
① 甲同学认为SCN—中碳元素没有被氧化,理由是 。
② 取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是 。
③ 通过实验证明了SCN—中氮元素转化为NO3-,他的实验方案是 。
④ 若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是______mol。
某同学对Cl2与KI溶液的反应进行了实验探究。反应装置如下:

通入氯气一段时间,KI溶液变为黄色。继续通入氯气一段时间后,溶液黄色褪去,变为无色。继续通入氯气,最后溶液变为浅黄绿色。
(1)Cl2与NaOH溶液反应的化学方程式是 。
(2)KI溶液变为黄色说明氯气具有的 性,该反应的离子方程式 。
(3)已知I2+I- I3-,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行以下实验。
I3-,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行以下实验。
①实验b的目的是 。
②根据实验a中,水层中含有的粒子有 。
③用化学平衡原理解释实验a中水溶液颜色变浅的原因: 。
④为保证实验的严谨性,在实验a、b的基础上,需补充一个实验,该实验为 。
(4)通入氯气,溶液由黄色变为无色,是因为氯气将I2氧化。已知1 mol Cl2可氧化0.2 mol I2,该反应的化学方程式是 。
(5)根据上述实验,请预测向淀粉-KI溶液中持续通入氯气,可能观察到的现象为 。
(6)溶液最终变为浅绿色的原因是 。
(14分,每空2分)某中学的化学兴趣小组对SO2与漂白粉的反应进行实验探究,实验过程如下:取10克漂白粉固体,加入250mL水中,部分固体溶解溶液略有颜色,过滤后用洁净的玻璃棒沾取滤液到pH试纸上,发现pH试纸先变蓝(约为12)后褪色.回答下列问题:
(1)工业制取漂白粉的化学方程式是 。漂白粉在空气中变质的原因 (用化学反应方程式说明)。
(2)pH试纸颜色的变化说明漂白粉溶液具有的性质是 ,ClO2和漂白粉一样也具有强氧化性,其消毒效率(以单位物质的量得电子的数目表示)是Cl2的 倍;
(3)将SO2持续通入漂白粉溶液中,发现澄清透明的溶液先变为黄绿色,随后溶液中产生大量白色沉淀且黄绿色褪去。回答下列问题:
①澄清透明溶液变为黄绿色的可能原因是:随溶液酸性的增强,漂白粉的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是 ;
②用离子方程式解释现象中黄绿色褪去的原因: ;
③SO2与漂白粉的有效成分在酸性条件下反应的离子方程式: 。
(11分)(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为10mL):
| 实验编号 |
实验温度/℃ |
c(Na2S2O3)/mol·L-1 |
c(H2SO4)/mol·L-1 |
| ① |
25 |
0.1 |
0.1 |
| ② |
25 |
0.2 |
0.1 |
| ③ |
25 |
0.1 |
0.2 |
| ④ |
50 |
0.2 |
0.1 |
| ⑤ |
50 |
0.1 |
0.1 |
其他条件不变时:探究温度对化学反应速率的影响,应选择_______(填实验编号);
探究浓度对化学反应速率的影响,应选择_________(填实验编号);
若同时选择①②③溶液变浑浊的时间,探究__________对化学反应速率的影响。
(2)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子。该反应的离子方程式是__________。
甲同学设计如下实验流程探究Na2S2O3的化学性质。
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和_________性。
(Ⅱ)加入BaCl2溶液生成白色沉淀B的离子方程式是_________________。
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是____(填“甲”或“乙”),理由是__________________。
某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是__________。
| 第1组 |
第2组 |
第3组 |
| S(单质) |
SO2、X、Na2SO3、NaHSO3 |
SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)

①装置I模拟工业生产中SO2催化氧化的反应,其化学方程式是________________。
②甲同学按I、II、III、IV的顺序连接装置,装置II的作用是__________;装置III中溶液逐渐褪色,生成Mn2+,则该反应的离子方程式是_______________。
③乙同学按I、II、IV的顺序连接装置,若装置IV中有40 mL 2.5 mol•L-1 NaOH溶液,反应后增重4.8 g,则装置IV中发生总反应的化学方程式是_______________。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,应选用 (选填序号)。
a.KSCN溶液和氯水 b.K3Fe(CN)6溶液
c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为 。
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。

(3)装置B中试剂的作用是 。
(4)认为气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于 (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是 。
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:氧化性: >Fe3+>I2;还原性:S2O32—>I-。3I2+6OH-=IO3—+5I-+3H2O;KI+I2
>Fe3+>I2;还原性:S2O32—>I-。3I2+6OH-=IO3—+5I-+3H2O;KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是________(填化学式);CCl4中显紫红色的物质是_________(用化学式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为____________、____________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境下KI与氧气反应的化学方程式:________________。将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由__________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是__________________。
| A.Na2S2O3 | B.AlCl3 | C.Na2CO3 | D.NaNO2 |
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+____________________。
某化学兴趣小组为了测定铁碳合金(铁和碳两种单质的混合物)中铁的质量分数,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。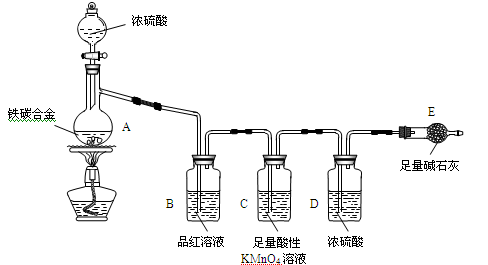
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后______________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,加热,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。铁碳合金中铁的质量分数为_________________(写表达式)。
(3)装置C的作用______________________。
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、水蒸气进入E管使b增大。你认为改进的方法是 。
(5)乙同学认为,即使甲同学认为的偏差得到改进,依据此实验测得合金中铁的质量分数也可能会偏高。你认为其中的原因是 。
(14分)某学生设计了一套验证物质化学性质的实验装置(如图):
请观察该装置图,完成下列问题:
(1)该实验的目的是 。
(2)该实验的涉及的化学方程式有 。
(3)实验用品:实验仪器除铁架台(带铁夹)、储气瓶(两个)、直管活塞(K1、K2)、止水夹(K3)、橡胶管、橡胶塞以及若干玻璃管连件外,还有哪几种(写仪器名称)_________________。
(4)实验步骤:①按上图连接好仪器装置;②扭开活塞K1和K2,主要现象为 ;③关闭 ,(填写K1或K2或K3)打开 ,(填写K1或K2或K3), 用手或热毛巾捂住圆底烧瓶,就能使烧瓶产生喷泉。
为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上可用铁质容器盛放冷的浓硫酸,其原因是 。
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+,产生Fe2+的离子反应方程为: ,检验是否有Fe2+应选用下列 (选填序号)试剂。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液
C.浓氨水 D.酸性KMnO4溶液
②乙同学取560mL(标准状况下)气体Y通入足量溴水中,可以发生:SO2+Br2+2H2O=2HBr+H2SO4反应,然后加入足量BaCl2溶液,经正确操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为 。
【探究二】
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1是相对分子质量最小的气体,在标准状况下,密度为0.0893g·L-1,Q2是空气的成份之一。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。
(3)装置B中试剂的作用是 ;
(4)用化学方程式表示Y气体中的Q2气体是如何生成的: ;
(5)为确认Q2的存在,需在装置中添加洗气瓶M于 (选填序号)。
A.A之前 B.A-B间 C.B-C间 D.C-D间
(14分) 孔雀石呈绿色,是一种名贵的宝石。其主要成分是xCu(OH)2·yCuCO3。某兴趣小组为探究孔雀石组成,利用下图所示的装置(夹持仪器省略)进行实验:
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于硬直玻璃管中。
步骤2:称量相关装置的质量,打开活塞K,鼓入空气,一段时间后关闭。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4:_________________________ (请补充该步操作内容)。
步骤5:冷却至室温,称量相关装置的质量。
(1)孔雀石热分解的化学方程式_____________________________。
(2)装置A的作用是__________________;若无装置E,则实验测定的x/y的值将__________(选填“偏大”、“偏小”或“无影响”)。
(3)某同学在实验过程中采集了如下数据:
| A.反应前玻璃管与样品的质量163.8g |
| B.反应后玻璃管中残留固体质量20g |
| C.装置C实验后增重2.25g |
| D.装置D实验后增重5.5g |
为测定x/y的值,你认为可以选用上述所采集数据中的_________________
(写出所有组合的字母代号)任一组即可进行计算,并根据你的计算结果,写出孔雀石组成的化学式________。
甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
| 操 作 |
现 象 |
通入氯气至过量 |
I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
(1)B中反应的离子方程式是 。
(2)A中溶液变红的原因是 。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。甲同学的实验证明产生现象II的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为  。
。
①甲同学认为SCN—中碳元素没有被氧化,理由是 。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是 。
③通过实验证明了SCN- 中氮元素转化为NO3-,他的实验方案是 。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是 mol。