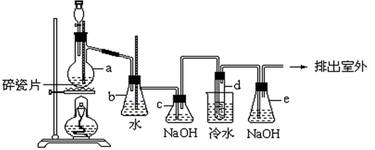
甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
| 操 作 |
现 象 |
 |
I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
(1)B中反应的离子方程式是 。
(2)A中溶液变红的原因是 。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象II的原因是SCN—与Cl2发生了反应。
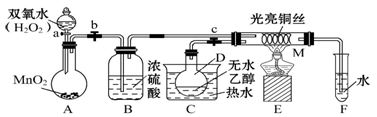
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为  。
。
① 甲同学认为SCN—中碳元素没有被氧化,理由是 。
② 取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是 。
③ 通过实验证明了SCN—中氮元素转化为NO3-,他的实验方案是 。
④ 若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是______mol。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号