室温下,将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到了蓝色沉淀。为了确定沉淀的组成,某研究性学习小组进行了以下试验和研究。
(一)【提出假说】
假设一:两者反应只生成CuCO3沉淀;
假设二:两者反应只生成Cu(OH)2沉淀; 假设三: ;
假设三: ;
(二)【理论探究】
查阅资料:CuCO3和Cu(OH)2均不带结晶水;
KSP〔CuCO3〕=1.4×10-10 KSP〔Cu(OH)2〕=5.6×10-20
若只由此数据结合适当计算来判断,假设 是正确的。
(三)【实验探究】
步骤一:将CuSO4溶液倒入等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来,其操作方法为:①过滤 ,② ,③干燥。
步骤三:利用下图所示装置,进行定量分析:
① A装置中玻璃仪器的名称是 。
② 仪器组装好后首先要进行的实验操作是 。
③ 实验结束时通入过量的空气的作用是 。
④ 数据记录:
| |
B装置的质量(g) |
C装置的质量(g) |
D装置的质量(g) |
| 实验前 |
15.4 |
262.1 |
223.8 |
| 试验后 |
6.1 |
264.8 |
230.4 |
(四)【实验结论】
利用上述数据初步判断该沉淀的成分是CuCO3和Cu(OH)2,在沉淀中二者的物质的量之比为 。若所得沉淀是纯净物而不是混合物,请写出该物质的化学式 。
甲酸为不溶于水易溶于乙醇的无色晶体,苯酚常温下能溶于水,易溶于酒精。酸性强弱为:盐酸>苯甲酸>碳酸>苯酚>碳酸氢钠。现有苯甲酸、苯酚一起溶于乙醇所得的混合液,设计一个简单的实验方案,把这三种物质分离为各自的纯净物。按分离的先后顺序的多种可能方案:
方案一:按酸性由弱到强顺序分离
方案二:按酸性由强到弱顺序分离;
……
供选择试剂:①10%氢氧化钠溶液②37%盐酸③Na2CO3溶液④NaHCO3溶液⑤大理石⑥KMnO4溶液⑦生石灰⑧10%H2SO4
(1) 甲同学按实验方案一进行,请填写相关内容。
| 实验步骤 |
写出相应的离子方程式 |
| ①取试样加入足量10%的NaOH溶液,充分振荡后再将反应混合物倒入蒸馏烧瓶中蒸馏得到乙醇、水的混合物和产品A |
①OH-+C6H5-OH→C6H5O-+H2O ② |
| ②向步骤①的馏分中加入足量的生石灰,再次蒸馏浓缩,蒸气冷凝后得乙醇。 |
CaO+H2O=Ca(OH)2 |
| ③向产品A中通入足量CO2,静置后分液得 和溶液B。 |
|
| ④再向溶液B中加入足量 、静置、过滤后可得苯甲酸。 |
|
(2)方案一中需要蒸馏操作,该操作需要的仪器除了铁架台、酒精灯、石棉网、接液管、锥形瓶和连接导管、橡胶塞外还要有 。
(3)方案一需要制取CO2应选用下述哪种装置 (填符号),该装置检验气密性的方法是 。
某化学兴趣小组想探究某一温度下氯化钠饱和溶液的酸碱度。探究过程如下:
【猜想或假设】溶液的pH可能为:①pH<7,② ,③ 。
【设计和实验】要测定该溶液的酸碱度,除有正确的操作步骤外,其中不能采用下列物质中的 (填序号)来进行实验。
①pH试纸 ②紫色石蕊试液 ③酚酞试液
组内同学进行了如下实验:
甲同学:取pH试纸放在玻璃片上,用玻璃棒蘸取氯化钠溶液沾在pH试纸上,把试纸显示的颜色与标准比色卡比较,测得pH=7。
乙同学:取pH试纸放在玻璃片上,先用蒸馏水将pH试纸润湿,然后用玻璃棒蘸取氯化钠溶液沾在pH试纸上,把试纸显示的颜色与标准比色卡比较,测得pH=7。
丙同学:将pH试纸直接浸入氯化钠溶液中,把试纸显示的颜色与标准比色卡比较,测得pH=7。
【评价与反思】三位同学中操作正确的是 同学。
指出其于同学的操作错误:
同学: ;
同学: ;
【结论与分析】丙同学得出:“凡是盐溶液的pH都等于7”,你认为该同学结论
(填“正确”或“不正确”)。
如不正确,请举一例说明 (如正确,该处不填)。
某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。

⑴ m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是
①常温下碳与浓硫酸不反应;② 。
⑵写出加热时A中碳与浓硫酸发生反应的化学方程式 。
⑶B中的现象是: ;C的作用是: 。
⑷待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为 (写表达式)。
⑸甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因: 。
⑹最后对所得测量结果进行评价,小组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低是(任答一条即可) 。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌,亚氯酸钠受热易分解。以氯酸钠(NaClO3)等为原料制备亚氯酸钠的工艺流程如下:
(1)提高“反应1”反应速率的措施有 。(回答一点即可)
(2)“反应1” 的离子方程式是 。
(3)“反应2”的氧化剂是 ,该反应的化学方程式为 。
(4)采取“减压蒸发”而不用“常压蒸发”,原因是 。
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定至终点,重复2次,测得平均值为V mL 。
(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为 。
②该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,结果化成最简。)
某同学探究同周期元素性质递变规律时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
| 实验步骤 |
实验现象 |
| ①将一小块金属钠放入滴有酚酞的冷水中 |
A.剧烈反应,产生大量无色气体。 |
| ②将镁条用砂纸打磨后,放入沸水中,再向溶液中滴加酚酞溶液 |
B.浮在水面,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
| ③将镁条放入稀盐酸中 |
C.生成淡黄色沉淀。 |
| ④将铝条放入稀盐酸中 |
D.反应较快,产生无色气体。 |
| ⑤向AlCl3溶液中滴加NaOH 溶液至过量 |
E.有气体产生,溶液变成浅红色。 |
| ⑥向新制的Na2S溶液中滴加新制的氯水 |
F.产生白色胶状沉淀,继而沉淀消失。 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究同周期元素性质递变规律。
(2)实验药品:金属钠、镁条、铝条、稀盐酸、新制氯水、新制Na2S溶液、AlCl3溶液、NaOH 溶液等。
实验仪器:试管、试管夹、酒精灯、胶头滴管、镊子、小刀、玻璃片、砂纸等。
(3)实验内容(填写与实验步骤对应的实验现象的标号和化学方程式)
| 实验内容 |
实验现象 |
化学方程式 |
| ① |
B |
|
| ② |
|
Mg + 2H2O  Mg(OH)2 + 2H2 ↑ Mg(OH)2 + 2H2 ↑ |
| ③ |
|
Mg + 2HCl = MgCl2 + H2↑ |
| ④ |
D |
|
| ⑤ |
|
AlCl3 + 3NaOH = Al(OH)3↓+ 3NaCl Al(OH)3 + NaOH = NaAlO2 + 2H2O |
| ⑥ |
|
Na2S + Cl2 =" 2NaCl" + S↓ |
(4)实验结论: 。
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置。

实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中的湿润的红色纸条褪色,证明A中反应有 (填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因 。
(2)装置C的作用是 。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为① ;
② 。
(4)实验证明,Na2O2能与干燥的HCl反应,完成并配平该化学方程式。

在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。a和b分别是

| |
a(干燥气体) |
b(液体) |
| A |
NO2 |
水 |
| B |
CO2 |
水 |
| C |
Cl2 |
饱和食盐水 |
| D |
NH3 |
水 |
为探究铜丝在酒精灯火焰上灼烧后表面黑色固体的成分,设计如下过程:
(1)提出假设:黑色固体可能是C、______中的一种或两种。
(2)验证假设:灼烧后的铜丝插入足量稀硫酸中,若溶液变蓝,说明必有__________;若溶液中有黑色不溶物,说明必有__________
某同学按下图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液。请回答下列问题。

(1)通Cl2一段时间后,A中观察到的现象是___________________,B中观察到的现象是___________________,由此可得出的结论是____ ___,写出有关反应的离子方程式:______________________________。
(2)C装置的作用是___________________,写出有关反应的离子方程式:_____________________
为探究一溴环己烷( )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。
其中正确的是
| A.甲 | B.乙 |
| C.丙 | D.上述实验方案都不正确 |
(届四川省泸州市高三第一次诊断性考试化学试卷)
在高温时硫铁矿(主要成分FeS2)和氧气反应生成三氧化二铁和二氧化硫(假设硫铁矿中的杂质不参与化学反应)。某化学研究学习小组对硫铁矿样品进行如下实验探究:
【实验一】测定硫元素的含量
I.实验装置如下图所示(夹持和加热装置已省略)。A中的试剂是双氧水,将m·g该硫铁矿样品放人硬质玻璃管D中。从A向B中逐滴滴加液体,使气体发生装置不断地缓缓产生气体,高温灼烧硬质玻璃管D中的硫铁矿样品至反应完全。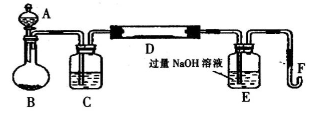
II.反应结束后,将E瓶中的溶液进行如下处理:
【实验二】测定铁元素的含量
III.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解已冷却的硬质玻璃管D中的固体,过滤,得到滤液A;
②在滤液A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
③将滤液B稀释为250 mL;
④取稀释液25.00 mL,用浓度为c mol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体
积的平均值为V mL。
请根据以上实验,回答下列问题:
(1)I中装置C中盛装的试剂是_ ;E瓶的作用是_ 。
(2)11中加入过量H2O2溶液发生反应的离子方程式为____。
(3)111的步骤③中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,
还必须要用到的是_ ;④中盛装KMnO3溶液的仪器是_ 。
(4)假设在整个实验过程中硫元素和铁元素都没有损失,则该硫铁矿样品中硫元素的质量分数为_ 。(用含m1和m2的代数式表示);铁元素的质量分数为____。(用含m1、c、v的代数式表示)
下表是稀硫酸与某金属反应的实验数据:
| 实验 序号 |
金属 质量/g |
金属 状态 |
c(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失的时间/S |
|
| 反应前 |
反应后 |
||||||
| 1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
| 2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
| 3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
| 4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
| 5 |
0.10 |
粉末 |
0. 8 |
50 |
20 |
36 |
25 |
| 6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
| 7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
| 8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
| 9 |
0.10 |
丝 |
1.1 |
50 |
20 |
44 |
40 |
分析上述数据,回答下列问题:
(1) 实验4和5表明_________对反应速率有影响;________,反应速率越快,能表明这一规律另一组实验是___________(填实验序号)。
(2) 在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有________(填实验序号)。
(3) 本实验中影响反应速率的其他因素还有_________,其实验序号是_____。
(4) 实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
_________________________________________________________。
三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0 mol·L-1 硝酸、1.0 mol·L-1 盐酸、1.0 mol·L-1 NaOH溶液、3% H2O2、0.1 mol·L-1 KI溶液、0.1 mol·L-1 CuSO4溶液、20% KSCN溶液、澄清石灰水、氧化铜、蒸馏水。
(1)将气体产物依次通过(A)澄清石灰水、浓氢氧化钠 (B)浓硫酸、灼热氧化铜 (C)澄清石灰水;观察到(A)、(C)中澄清石灰水都变浑浊,(B)中有红色固体生成,则气体产物是 。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是 。
(3)固体产物中铁元素存在形式的探究。
① 提出合理假设
假设1: ;
假设2: ;
假设3: 。
② 设计实验方案证明你的假设
| 实验步骤 |
预期现象与结论 |
| 步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使K2CO3完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体。 |
固体部分溶解。 |
| 步骤2: |
|
| 步骤3: |
|
| |
|
(4)若假设1成立,K3[Fe(C2O4)3]分解反应的化学方程式为 。