北京门头沟区高三年级抽样测试理科综合能力测试化学部分
“分类”是一种思想方法,在化学发展中起到了重要作用。下列分类标准合理的是
①根据水溶液能否导电将化合物分为电解质和非电解质
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学反应分为放热反应和吸热反应
| A.②④ | B.①② | C.①③ | D.③④ |
已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是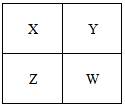
| A.Z元素的原子半径可能比Y元素的小 |
| B.W的原子序数可能是Y的原子序数的2倍 |
| C.W的气态氢化物的稳定性一定比Y的强 |
| D.Z的化学活泼性一定比X强 |
下列叙述中的前后两个量之比为1 :2的是
| A.液面在 “ 0 ” 刻度时,25mL碱式滴定管和50mL碱式滴定管所盛液体的体积 |
| B.相同温度下,0.1mol /L乙酸溶液与0.2mol /L乙酸溶液中,c(H+)之比 |
C.氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH ): c(SO ): c(SO ) ) |
| D.相同温度下,pH=12的Ba(OH)2与pH=12的KOH溶液中,c〔(Ba(OH)2〕: c(KOH) |
关于下列各装置图的叙述中,正确的是
| A.若采用装置①精炼铜,则a极为纯铜, b极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②是原电池,能将化学能转化为电能,锌电极发生还原反应 |
| C.装置③中X若为四氯化碳,则此装置可用于吸收氨气,并防止倒吸 |
| D.装置④可用于实验室配置一定物质的量浓度的稀硫酸 |
某有机物A是农药生产中的一种中间体,其结构简式如下,下列叙述正确的是
| A.有机物A属于芳香烃 |
| B.有机物A和浓硫酸混合加热,可以发生消去反应 |
| C.有机物A的核磁共振氢谱有7个峰 |
| D.1molA和足量的NaOH溶液反应,最多可以消耗3molNaOH |
下列反应的离子方程式正确的是
A.碳酸钠的水解反应:CO +H3O+ +H3O+ HCO HCO +H2O +H2O |
| B.向100mL0.1mol/L的FeBr2溶液中缓慢通入标准状况下的224mLCl2: 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| C.在氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7: Ba2++OH-+H++SO  =BaSO4↓+H2O =BaSO4↓+H2O |
| D.向氯化银悬浊液中加入饱和碘化钾溶液:Ag++ I-= AgI ↓ |
若氧元素只有16O、18O两种核素,下列说法正确的是
| A.16O2与18O2互为同位素 |
B.向2SO2(g) + O2(g) 2SO3(g) 的平衡体系中加入18O2,达到新的平衡后18O2只出现在O2与SO3中 2SO3(g) 的平衡体系中加入18O2,达到新的平衡后18O2只出现在O2与SO3中 |
| C.CH3COOH和CH3CH218OH发生酯化反应时,产物中分子式为H218O |
| D.用惰性电极电解含有H218O的普通水时,阳极可能产生三种相对分子质量不同的氧分子 |
中学化学的常见物质,它们在一定条件下有如下转化关系: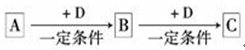
⑴若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。
则A转化为B反应的化学方程式为 。
⑵若D是具有氧化性的单质,A元素属于短周期主族金属元素,
则C的电子式为 。
⑶若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明) 。
⑷若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为 。
⑸若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为 。
⑹若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为 。
科学家一直致力于“人工固氮”的方法研究。
⑴目前合成氨的技术原理为:
该反应的能量变化如图所示。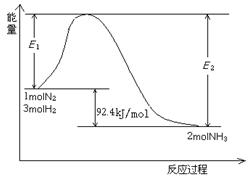
①在反应体系中加入催化剂,反应速率增大,E2的变化是: 。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。
③欲提高②容器中H2的转化率,下列措施可行的是 。
| A.向容器中按原比例再充入原料气 |
| B.向容器中再充入惰性气体 |
| C.改变反应的催化剂 |
| D.液化生成物分离出氨 |
⑵1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为 。
⑶根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应: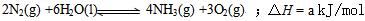
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K |
303 |
313 |
323 |
| NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
①此合成反应的a_ 0。(填“大于”、“小于”或“等于”)
②已知
⑷ NH4Cl溶液呈酸性,这是由于NH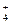 水解的缘故。则NH4Cl在重水(D2O)中水解的离子方程式是 。
水解的缘故。则NH4Cl在重水(D2O)中水解的离子方程式是 。
某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。

⑴ m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是
①常温下碳与浓硫酸不反应;② 。
⑵写出加热时A中碳与浓硫酸发生反应的化学方程式 。
⑶B中的现象是: ;C的作用是: 。
⑷待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为 (写表达式)。
⑸甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因: 。
⑹最后对所得测量结果进行评价,小组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低是(任答一条即可) 。
奶油中含有有一种可作香料的化合物A,A中只含C、H、O三种元素。通过红外光谱图分析可知A中含有碳氧双键;通过李比希法分析得到A分子中C、H、O原子个数比为2:4:1,通过质谱仪分析其相对分子质量为88。
已知:
与A相关的反应如下:
⑴ A的分子式为 ,H的结构简式为 。
⑵上述7步反应中属于取代反应的是 (填序号)。
⑶写出B → D反应的化学方程式: 。
⑷ B的核磁共振氢谱图中共有 个峰。
⑸在空气中长时间搅拌奶油,A可转化为相对分子质量为86的化合物G。G有多种同分异构体,其中符合下列两个条件的同分异构体共有 种。
A.无环状结构 B.不含碳碳双键和碳碳叁键
⑹请设计合理方案从 合成OHC(CH2)4CHO(用反应流程图表示,注明反应物、反应条件;无机试剂可自选)。
合成OHC(CH2)4CHO(用反应流程图表示,注明反应物、反应条件;无机试剂可自选)。
反应流程图示例(由乙醇合成聚乙烯):
 粤公网安备 44130202000953号
粤公网安备 44130202000953号