山西省高三第四次四校联考(理综)化学部分
下列措施有利于节能减排、改善环境质量的有 ① 在大亚湾核电站已安全运行多年的基础上,广东将继续发展核电,以减少火力发电带来的二氧化硫
① 在大亚湾核电站已安全运行多年的基础上,广东将继续发展核电,以减少火力发电带来的二氧化硫 和二氧化碳排放问题
和二氧化碳排放问题 ②积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料
②积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料 ③加速建设地铁、轻轨等轨道交通,促进珠三角城市一体化发展,减少汽车尾气排放
③加速建设地铁、轻轨等轨道交通,促进珠三角城市一体化发展,减少汽车尾气排放 ④日本核泄漏产生的污染物之一放射性碘131(13153I)原子和碘127(12753I)原子属于同素异形体
④日本核泄漏产生的污染物之一放射性碘131(13153I)原子和碘127(12753I)原子属于同素异形体 ⑤使用生物酶降解生活废水中的有机物,使用填埋法处理未经分类的生活垃圾
⑤使用生物酶降解生活废水中的有机物,使用填埋法处理未经分类的生活垃圾
| A.①②③ | B.①②④⑤ | C.①②④⑤ | D.③④⑤ |
某课外实验小组设计的下列实验合理的是
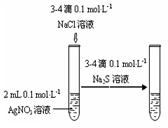 |
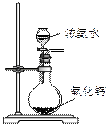 |
 |
 |
|
|
下列关于有机物的说法正确的是
| A.乙烯和苯都能使溴水褪色,褪色的原理相同 |
| B.淀粉、蛋白质完全水解的产物互为同分异构体 |
| C.石油裂解和油脂皂化都有高分子生成小分子的过程 |
| D.乙醇、乙酸、乙酸乙酯都能发生取代反应,且乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
某有机物的结构简式: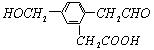
它在一定条件下可能发生的反应有:①加成反应 ②水解反应 ③酯化反应 ④氧化反应 ⑤中和反应 ⑤消去反应 C
下列是某同学对相应反应的离子方程式所作的评价,其中结论与评价合理的是
| 编号 |
化学反应 |
离子方程式 |
结论与评价 |
| A |
在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4: |
4OH-+3ClO-+2Fe(OH)3 2FeO42-+3Cl-+5H2O 2FeO42-+3Cl-+5H2O |
错误,产物中应该生成氯气 |
| B |
漂白粉溶液露置在空气中会失效 |
ClO-+CO2+H2O=HClO+HCO3- |
错误,产物应为HClO和CaCO3沉淀 |
| C |
氯化铝溶液中加入过量氨水 |
Al3+ + 4NH3·H2O="=" AlO2- + 4NH4++2H2O |
错误,产物应写成NH4AlO2 |
| D |
NH4HSO3溶液与少量的NaOH溶液混合加热 |
H++OH-=H2O |
正确 |
设NA是阿伏加德罗常数的值,下列说法正确的是
| A.1mol硫与1mol铜在加热条件下充分反应转移电子数为NA |
B.已知2CO(g)+O2(g)  2CO2(g); △H=-akJ﹒mol-1将2NA个CO与NA个O2混合充分反应放出akJ的热量。 2CO2(g); △H=-akJ﹒mol-1将2NA个CO与NA个O2混合充分反应放出akJ的热量。 |
| C.分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
| D.3.4 g NH3中含N—H键数目为0.2 NA |
从下列事实所得出的结论或给出的解释正确的是
| |
实验事实 |
结论或解释 |
| ① |
将40 g NaOH溶于1 L蒸馏水中 |
该 溶液中溶质的质量分数为3.84%,其物质的量浓度为1mol﹒L-1 |
| ② |
在溶液的稀释过程中 |
离子浓度有的可能增大,有的可能减小,有的可能不变 |
| ⑶ |
某盐NaX溶液pH > 7 |
酸HX为弱酸 |
| ④ |
0.1 mol/L CH3COOH溶液在稀释过程中 |
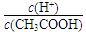 将变小 将变小 |
| ⑤ |
向盛有浓硝酸的试管中分别加入Al片和 Cu片,前者没有明显现象,后者反应剧烈,产生大量红棕色气体 |
还原性Al < Cu[ |
| ⑥ |
BaSO4的水溶液导电性很差 |
BaSO4是弱电解质 |
| A.①④⑤ | B.③④⑥ | C.②③ | D.②④⑥ |
短周期元素形成的纯净物A、B、C、D、E的转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。
请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的一 种化学式 。
种化学式 。
(2)若E的水溶液呈现弱酸性,D是既能溶于强酸、又能溶于强碱的化合物。
①用电离方程式解释D既能溶于强酸,又能溶于强碱的原因 。
②E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间大小关系 。
(3)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为 。
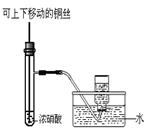
②有人认为“浓H2SO4可以干燥气体C”。某同学为了验证该观点是否正确,用下图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,浓硫酸变为红棕色,则你得出的结论是 。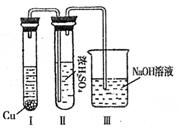
③已知常温下物质A与物质B生成1mol气体C的△H为-57.07kJ·mol-1,1 mol气体C与H2O反应生成D溶液和E气体的△H为-46kJ ·mol-1,写出物质A与物质B及水生成D溶液的热化学方程式 。
三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0 mol·L-1 硝酸、1.0 mol·L-1 盐酸、1.0 mol·L-1 NaOH溶液、3% H2O2、0.1 mol·L-1 KI溶液、0.1 mol·L-1 CuSO4溶液、20% KSCN溶液、澄清石灰水、氧化铜、蒸馏水。
(1)将气体产物依次通过(A)澄清石灰水、浓氢氧化钠 (B)浓硫酸、灼热氧化铜 (C)澄清石灰水;观察到(A)、(C)中澄清石灰水都变浑浊,(B)中有红色固体生成,则气体产物是 。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是 。
(3)固体产物中铁元素存在形式的探究。
① 提出合理假设
假设1: ;
假设2: ;
假设3: 。
② 设计实验方案证明你的假设
| 实验步骤 |
预期现象与结论 |
| 步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使K2CO3完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体。 |
固体部分溶解。 |
| 步骤2: |
|
| 步骤3: |
|
| |
|
(4)若假设1成立,K3[Fe(C2O4)3]分解反应的化学方程式为 。
.I下表是部分短周期元素的原子半径及主要化合价:
| 元素代号[ |
W |
R |
X |
Y |
Z |
Q |
M |
| 原子半径/nm |
0.037 |
0.186 |
0.074 |
0.075 |
0.077 |
0.150 |
0.160 |
| 主要化合价 |
+1 |
+1 |
-2 |
-3、+5 |
+2、+4 |
+3 |
+2 |
试用元素符号 、化学式回答下列问题:
、化学式回答下列问题:
(1)七种元素中原子半径最大的元素在周期表中位置是 。
M在Z的最高价氧化物中燃烧的化学方程式 。
(2)X可与R按1︰1的原子个数比形成化合物甲,甲中存在的化学键有 ;
X可与W组成含18电子的化合物乙,则乙的电子式为 。
(3)上述元素组成的物质D、E在体积不变的密闭容器中发生可逆反应:2E(g)+D(g) 2G(g)根据下表中的数据判断下列图像错误的是 。
2G(g)根据下表中的数据判断下列图像错误的是 。
 |
p1(MPa) |
P2(MPa) |
| 200 |
78.4 |
90.6 |
| 600 |
72.3 |
88.6 |
|
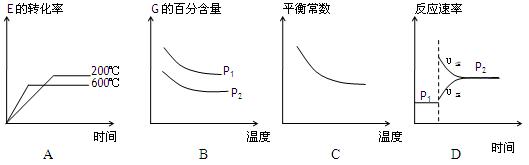
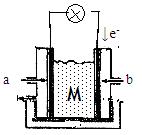
(1)若M为氢氧化钾溶液,
(2)若M为熔融的碳酸钾
(3)若M为传递O2-的固体电解质
III一定量的浓硝酸与足量的铁铜合金反应,硝酸被还原
为NO 、 NO2 、 N2O4 ,其标准状况下的体积均为112mL ,若向所得溶液中加入0.1mol/L的氢氧化钠溶液 mL恰好能使溶液中的金属离子沉淀完全。
玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂有苯酚和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向已有苯酚的反应釜中____________加入甲醛,且反应釜应装有________装置。
(2)玻璃纤维由玻璃拉丝得到。普通玻璃是由石英砂、______和石灰 石(或长石)高温熔融而成,主要反应的化学方程式为_____________________________________。
石(或长石)高温熔融而成,主要反应的化学方程式为_____________________________________。
(3)玻璃钢中玻璃纤维的作用是__________。玻璃钢具有___________等优异性能(写出亮点即可)。
(4)下列处理废旧热固性酚醛塑料的做法合理的是_________。
a.深埋 b.粉碎后用作树脂填料
c.用作燃料 d.用有机溶剂将其溶解,回收树脂
(1)如图所示为冰晶石(化学式为 Na3AlF6)的晶胞。图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种。图中●、○分别指代哪种粒子 、 ;大立方体的体心处▽所代表的是 (用化学式表示)。
Na3AlF6)的晶胞。图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种。图中●、○分别指代哪种粒子 、 ;大立方体的体心处▽所代表的是 (用化学式表示)。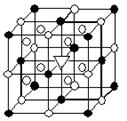
(2)H2S和H2O2的主要物理性质比较如下:
| |
熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
| H2S |
187 |
202 |
2.6 |
| H2O2 |
272 |
423 |
以任意比互溶 |
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因
。
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有_______(填元素符号)。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有 。实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4·H2O晶体。实验中所加C2H5OH的作用是 。
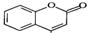 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成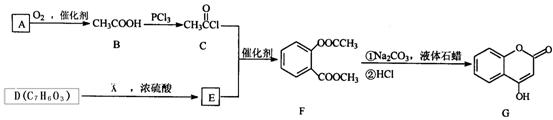
 粤公网安备 44130202000953号
粤公网安备 44130202000953号