钢铁发生吸氧腐蚀时,正极上发生的电极反应是
| A.2H++2e— ===H2 ↑ | B.Fe-2e—===Fe2+ |
| C.2H2O+O2+4e— ===4OH— | D.Fe-3e—===Fe3+ |
如图所示,装置中都盛有0.1mol·L-1的NaCl 溶液,放置一定时间后,装置中的四块相同的锌片腐蚀速率由快到慢的正确顺序是:( )

| A.①②③④ | B.①②④③ | C.②①④③ | D.③①④② |
下列相关化学知识的说法正确的是
| A.利用外接直流电源保护铁质建筑物,属于电化学中牺牲阳极的阴极保护法 |
| B.分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 |
| C.蛋白质和油脂在一定条件下都能水解,水解产物不同,但两者都属于高分子化合物 |
| D.分子数为NA的C2H4气体体积约为 22.4 L,其质量为 28 g(N A-阿伏加德罗常数) |
在钢铁腐蚀过程中,下列五种变化可能发生的是( )
①Fe2+转化为Fe3+②O2被还原③产生H2④Fe(OH)3失水形成Fe2O3·H2O⑤杂质碳被氧化
| A.只①② | B.只②③④ | C.①②③④ | D.①②③④⑤ |
如图,向还原铁粉中加入少量的炭粉,混合均匀后,撒入内壁用NaCl溶液润湿过的具支试管中,塞紧橡皮塞。几分钟后,打开止水夹,观察到导管中水柱上升。对此过程所作的分析正确的是
| A.铁粉在电化学腐蚀过程中作正极 | B.炭粉被氧化 |
| C.发生了吸氧腐蚀 | D.发生了析氢腐蚀 |
美籍华裔科学家钱永健曾于2008年获得诺贝尔化学奖。16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获有“少年诺贝尔奖”之称的著名奖项。下列说法正确的是:
| A.金属的电化学腐蚀和化学腐蚀都是金属原子失去电子而被还原的过程; |
| B.钢铁发生电化学腐蚀时,其先发生反应:Fe-3e- = Fe3+,继而形成铁锈; |
| C.减少钢铁中的含碳量,可以增强钢铁的耐腐蚀能力。 |
| D.金属的腐蚀会给社会带来巨大损失,所以金属的腐蚀是百害无一利的。 |
将铁棒与石墨棒用导线连接后浸入0.01 mol·L-1食盐溶液中,可能出现的现象是
| A.铁棒附近产生OH- | B.铁棒被腐蚀 |
| C.石墨棒上放出Cl2 | D.石墨棒上放出O2 |
关于下列各装置图的叙述中,不正确的是
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应式是Cu+2Fe3+====Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
下列有关金属腐蚀与防护的说法正确的是
| A.黄铜(铜锌合金)制作的铜锣易产生铜绿 |
| B.镀锡铁制品和镀锌铁制品的镀层破损时,镀锡铁中铁的腐蚀速率更快 |
| C.在轮船船体四周镶嵌锌块保护船体不受腐蚀的方法叫阳极电化学保护法 |
| D.不锈钢有较强的抗腐蚀能力是因为在钢铁表面上镀上了铬 |
下列有关金属腐蚀与防护的说法不正确的是
| A.钢铁在弱碱性条件下发生电化学腐蚀的正极电极反应式:O2+2H2O+4e-===4OH- |
| B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.牺牲阳极的阴极保护法,实际上“牺牲”的是原电池的负极 |
| D.可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀 |
下列与金属腐蚀有关的说法正确的是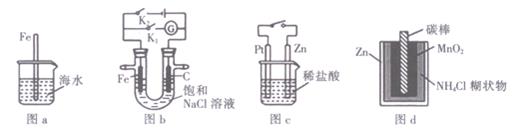
| A.图a中,插人海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,闭合K2,铁电极的腐蚀速率比闭合K1时慢 |
| C.图c中,接通开关时,Zn的腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,锌锰电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
用如图示的方法可以保护钢质闸门.下列说法正确的是( )

| A.当a、b间用导体连接时,则X应发生氧化反应 |
| B.当a、b间用导体连接时,则X可以是锌或石墨 |
| C.当a、b与外接电源相连时,a应连接电源的正极 |
| D.当a、b与外接电源相连时,阴极的电极反应式:2Cl﹣﹣2e→Cl2↑ |
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 |
表述I |
表述II |
| A |
氯气具有强氧化性 |
氯水能使有色物质褪色 |
| B |
SiO2既能与酸,又能与碱反应 |
SiO2是两性氧化物 |
| C |
锌的金属性比铁强 |
海轮外壳上装锌块可减缓腐蚀 |
| D |
Na2S还原性强 |
用于除去废水中的Cu2+和Hg2+ |
如图所示各烧杯中盛有海水,铁在其中被腐蚀,腐蚀的速率由快到慢的顺序为
| A.⑤②①④③ | B.③②⑤④① |
| C.⑤④③②① | D.⑤②①③④ |