下图小试管内为红墨水,具支试管内盛有pH=4久置的雨水和生铁片。实验观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。下列说法正确的是
| A.生铁片中的碳是原电池的负极,发生还原反应 |
| B.雨水酸性较强,生铁片始终发生析氢腐蚀 |
| C.墨水回升时,碳电极反应式为O2+2H2O+4e-===4OH- |
| D.具支试管中溶液酸性增强 |
某校活动小组为探究金属腐蚀的相关原理,设计了如下图a所示装置,图a的铁棒末段分别连上一块Zn片和Cu片,并静置于含有K3Fe(CN)6及酚酞的混合凝胶上。一段时间后发现凝胶的某些区域(如下图b示)发生了变化,已知Fe2+可用K3Fe(CN)6来检验(呈蓝色)。则下列说法不正确的是

| A.甲区呈现红色 | B.乙区产生Zn2+ |
| C.丙区发生的电极反应式:Cu-2e-= Cu2+ | D.丁区呈现蓝色 |
电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。

(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择________(填字母序号)。
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因:__________________________。
(2)图2中,钢闸门C做_____极。用氯化钠溶液模拟海水进行实验,D为石墨块,则D上的电极反应式为______________________,检测该电极反应产物的方法是_______________________。

(3)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的极________(填“正”或“负”)。F电极上的电极反应式为___________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因_______。
下列叙述不正确的是
| A.生铁中含有碳,抗腐蚀能力比纯铁弱 |
| B.在铁制品上镀铜时,石墨为阳极,铁制品作阴极,铜盐为电镀液 |
| C.用锡焊接的铁质器件,焊接处易生锈 |
| D.燃气灶上的炒锅支架容易生锈,主要是由于高温下铁易发生“化学腐蚀” |
如图,向还原铁粉中加入少量的炭粉,混合均匀后,撒入内壁用NaCl溶液润湿过的具支试管中,塞紧橡皮塞。几分钟后,打开止水夹,观察到导管中水柱上升。对此过程所作的分析正确的是
| A.铁粉在电化学腐蚀过程中作正极 | B.炭粉被氧化 |
| C.发生了吸氧腐蚀 | D.发生了析氢腐蚀 |
钢铁发生吸氧腐蚀时,正极上发生的电极反应是
| A.2H++2e— ===H2 ↑ | B.Fe-2e—===Fe2+ |
| C.2H2O+O2+4e— ===4OH— | D.Fe-3e—===Fe3+ |
如图所示,装置中都盛有0.1mol·L-1的NaCl 溶液,放置一定时间后,装置中的四块相同的锌片腐蚀速率由快到慢的正确顺序是:( )

| A.①②③④ | B.①②④③ | C.②①④③ | D.③①④② |
下列相关化学知识的说法正确的是
| A.利用外接直流电源保护铁质建筑物,属于电化学中牺牲阳极的阴极保护法 |
| B.分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 |
| C.蛋白质和油脂在一定条件下都能水解,水解产物不同,但两者都属于高分子化合物 |
| D.分子数为NA的C2H4气体体积约为 22.4 L,其质量为 28 g(N A-阿伏加德罗常数) |
下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面图。
下列说法正确的是
| A.该电化腐蚀为析氢腐蚀 |
| B.图中生成铁锈最多的是C区域 |
| C.A区域比B区域更易腐蚀 |
| D.铁闸中的负极的电极反应:Fe-2e-= Fe2+ |
下列有关金属腐蚀与防护的说法不正确的是
| A.钢铁在弱碱性条件下发生电化学腐蚀的正极电极反应式:O2+2H2O+4e-===4OH- |
| B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.牺牲阳极的阴极保护法,实际上“牺牲”的是原电池的负极 |
| D.可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀 |
下列与金属腐蚀有关的说法正确的是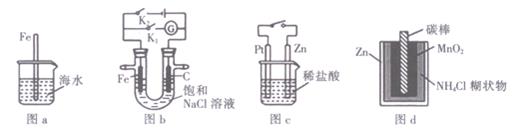
| A.图a中,插人海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,闭合K2,铁电极的腐蚀速率比闭合K1时慢 |
| C.图c中,接通开关时,Zn的腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,锌锰电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
用如图示的方法可以保护钢质闸门.下列说法正确的是( )

| A.当a、b间用导体连接时,则X应发生氧化反应 |
| B.当a、b间用导体连接时,则X可以是锌或石墨 |
| C.当a、b与外接电源相连时,a应连接电源的正极 |
| D.当a、b与外接电源相连时,阴极的电极反应式:2Cl﹣﹣2e→Cl2↑ |
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 |
表述I |
表述II |
| A |
氯气具有强氧化性 |
氯水能使有色物质褪色 |
| B |
SiO2既能与酸,又能与碱反应 |
SiO2是两性氧化物 |
| C |
锌的金属性比铁强 |
海轮外壳上装锌块可减缓腐蚀 |
| D |
Na2S还原性强 |
用于除去废水中的Cu2+和Hg2+ |
如图所示各烧杯中盛有海水,铁在其中被腐蚀,腐蚀的速率由快到慢的顺序为
| A.⑤②①④③ | B.③②⑤④① |
| C.⑤④③②① | D.⑤②①③④ |