钢铁生锈过程发生如下反应:①2Fe+O2+2H2O====2Fe(OH)2;
②4Fe(OH)2+O2+2H2O====4Fe(OH)3;
③2Fe(OH)3====Fe2O3+3H2O。下列说法正确的是
| A.当参加反应的O2等物质的量时,反应①、②中电子转移数目相等 |
| B.反应①中氧化剂是氧气和水 |
| C.与铜质水龙头连接处的钢质水管不易发生腐蚀 |
| D.钢铁在潮湿的空气中不能发生电化学腐蚀 |
下列有关说法正确的是
| A.在轮船表面涂刷富锌油漆,能有效防止船体在海水中被腐蚀 |
B.0.1 mol·L-1氨水加水稀释后,溶液中 的值减小 的值减小 |
| C.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 |
| D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
下列叙述I和II均正确且具有因果关系的是
| 编号 |
叙述I |
叙述II |
| A |
金属活动性铜比铁弱 |
镀铜铁制品表层划损后仍然受到保护 |
| B |
金属钠有还原性 |
用金属钠检验无水乙醇中是否含有少量水 |
| C |
Ksp(CaCO3)<Ksp(CaSO4) |
用Na2CO3溶液和盐酸除水垢CaSO4 |
| D |
Cl2具有漂白性 |
用氯气制盐酸 |
埋在地下的铸铁输油管道,在下列各种情况下,被腐蚀速率最慢的是
| A.在潮湿疏松的碱性土壤中 |
| B.在含铁元素较多的酸性土壤中 |
| C.在干燥致密不透气的土壤中 |
| D.在含碳粒较多,潮湿透气的中性土壤中 |
(16分)化学实验有助于理解化学知识,提升科学素养。
I.某探究小组用以下右图装置做如下实验。
| 实验编号 |
a中试剂 |
b中试剂 |
 |
| 1 |
0.1克Na、3 mL水 |
0.1克Na、3 mL乙醇 |
|
| 2 |
3 mL水 |
3 mL饱和FeSO4溶液 |
(1)实验1:同时加入试剂,反应开始阶段可观察到U形管中液面 (填编号,下同),反应结束静置一段时间,最终U形管中液面 。
a.左高右低 b.左低右高 c.左右基本持平
(2)实验2:一段时间后观察到U形管中液面左低右高, b管溶液中出现红褐色浑浊物,请解释出现上述现象的原因: 。
II.某研究小组为探究弱酸性条件下铁的电化学腐蚀类型,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图(1)所示)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(3)请填满表中空格,以完成实验设计:
| 编号 |
实验目的 |
炭粉/g |
铁粉/g |
醋酸浓度/mol/L |
| ① |
作参照实验 |
0.5 |
2.0 |
1.0 |
| ② |
探究醋酸浓度对实验的影响 |
0.5 |
|
0.1 |
| ③ |
|
0.2 |
2.0 |
1.0 |
(4)实验①测得容器中的压强随时间的变化如图(2)所示。该小组得出0~t1时压强增大的主要原因是: 。t2时,容器中压强明显变小的原因是 。请在图(3)中用箭头标出发生该腐蚀时A和B之间的电子移动方向。
利用如图装置,完成很多电化学实验。下列有关此装置的叙述中,正确的是
| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法 |
| B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阴离子向铁电极移动 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小 |
下列有关叙述中正确的是
| A.常用热还原法来冶炼Mg、Al、Fe |
| B.人们常采用牺牲阳极保护法防止通讯电缆发生腐蚀 |
| C.合成氨中采取及时分离液态氨的目的是提高反应速率 |
| D.海带中含有碘元素,只需经过物理变化就可以得到碘单质 |
铁制自来水管与下列材料作成的自来水龙头连接,自来水管锈蚀最快的是
| A.铁水龙头 | B.铜水龙头 | C.塑料水龙头 | D.陶瓷水龙头 |
【改编】下列叙述的原因不是由于原电池造成的是
| A.铁与酸反应滴加硫酸铜后反应加快 |
| B.金属在潮湿空气中更容易腐蚀 |
| C.镀锡铁镀层破损后腐蚀加快 |
| D.浓硝酸比稀硝酸更能氧化金属铜 |
【原创】现有A、B、C、D、E五种金属片,①把A、C用导线连接后同时浸入稀硫酸铜溶液中,A上有红色固体产生;②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生氧化反应;③把A、B用导线连接后同时浸入稀硫酸溶液中,电流方向为B→导线→A;④将E放入水中,立即有气体产生。根据上述情况,回答下列问题:
(1)在①中,金属片_______发生氧化反应;
(2)在②中,金属片_______作负极;
(3)如果把B、D用导线连接后同时浸入稀硫酸溶液,则金属片_______上有气泡产生;
(4)上述五种金属的活动性顺序是__________________。
铁、铜及其化合物在工农业生产中应用广泛。
(1)在潮湿空气中,钢铁发生电化学腐蚀转化为Fe(OH)2的反应方程式为 。在含有等浓度硫酸溶液的下列装置中,铁腐蚀的速率由快到慢的顺序是 (用序号填写)。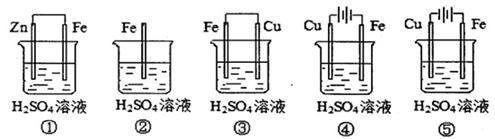
(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)  H="-1118" kJ·mol-1
H="-1118" kJ·mol-1
②2Al(s)+3/2O2(g)=A12O3(s)  H="-1675.7" kJ·mol-1
H="-1675.7" kJ·mol-1
则焊接钢轨时铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为 。
(3)Na2FeO4具有强氧化性,其电解制法如图所示,请写出阳极的电极反应式 。Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其原理是 。
(4)工业上常用FeCl3溶液腐蚀印刷线路板,发生反应的离子方程式是 。若腐蚀铜板后的溶液中,Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1,结合下图分析,当混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为 。从图中数据计算Fe(OH)2的溶度积Ksp[Fe(OH)2]= 。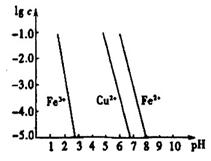
已知:横坐标为溶液的pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度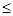 10-5 mol·L-1时,可认为沉淀完全)。
10-5 mol·L-1时,可认为沉淀完全)。
有关下列图像的说法正确的是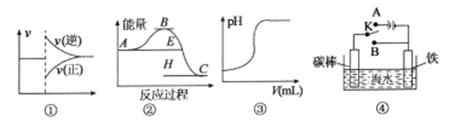
| A.图①可以表示,某化学平衡体系改变温度后反应速率随时间的变化 |
| B.根据图②判断,物质A反应生成物质C的△H>O |
| C.图③表示向一定量的硫酸溶液中滴加一定浓度氢氧化钠溶液时的pH变化 |
| D.图④中开关K置丁A或B处均可减缓铁的腐蚀 |
下列现象或反应的原理解释正确的是
| |
现象或反应 |
原理解释 |
| A. |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝箔对熔化的铝有较强的吸附作用 |
| B. |
合成氨反应需在高温条件下进行 |
该反应为吸热反应 |
| C. |
镀层破损后,镀锡铁比镀锌铁易腐蚀 |
锡比锌活泼 |
| D. |
2CO=C+O2在任何条件下均不能自发进行 |
该反应△H>0,△S<0 |
下列说法正确的是
| A.石油的分馏、煤的干馏、电解质溶液导电均属于物理变化 |
| B.钢铁生锈主要发生吸氧腐蚀,镀锌铁皮镀层破损后对铁失去保护作用 |
| C.14C与12C互称同位素;O2与O3是氧元素的同素异形体 |
| D.SO2和CO2属于酸性氧化物,Na2O和Al2O3属于碱性氧化物 |
下列叙述不正确的是
| A.铁表面镀锌,铁作阳极 |
| B.船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
| C.钢铁吸氧腐蚀的正极反应:O2 +2H2O+4e-=4OH— |
| D.工业上电解饱和食盐水的阴极反应:2Cl一 一2e一=C12↑ |