下列说法正确的是
| A.用上图所示方法可保护钢闸门不被腐蚀 |
| B.SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 |
C.常温下,NH4Cl溶液加水稀释, 增大 增大 |
D.C(s)+H2O(g) CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 |
下列说法正确的是
| A.用上图所示方法可保护钢闸门不被腐蚀 |
| B.SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 |
C.常温下,NH4Cl溶液加水稀释,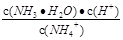 增大 增大 |
D.C(s)+H2O(g) CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 |
化学与社会、生活密切相关,下列有关说法中正确的是
| A.燃煤中加入CaO后可减少温室气体的排放量 |
| B.糖类、油脂、蛋白质都是人类重要的营养物质,均属于天然高分子化合物 |
| C.漂白粉、明矾均可用于饮用水处理,其化学原理相同 |
| D.在全球每年被腐蚀的金属中,电化学腐蚀比化学腐蚀所占比例高 |
下列用来表示物质变化的化学用语中,正确的是
| A.钢铁发生电化学腐蚀的正极反应式:Fe-2e-= Fe2+ |
B.HS-水解的离子方程式:HS-+H2O S2-+H3O+ S2-+H3O+ |
C.CO32-水解的离子方程式:CO32-+2 H2O H2CO3 +2OH- H2CO3 +2OH- |
| D.用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+ Hg2+(aq)=HgS(s)+Fe2+(aq) |
【原创】铁闸在海水中易被锈蚀,下图原理模型: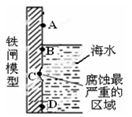
下列说法错误的是
| A.生成铁锈最多的是B点 |
| B.C处腐蚀时的电极反应为Fe-2e-=Fe2+ |
| C.以锌为负极,采用牺牲阳极法防止铁闸的腐蚀,可将锌放在C处。 |
| D.生锈最多的位置为腐蚀最严重的区域 |
下列说法正确的是
| A.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
| B.已知AgCl的Ksp=1.8×10-10、Ag2CrO4的Ksp=1.2×10-12,所以相同温度下AgCl的溶解度大于Ag2CrO4 |
| C.常温下,将pH =8的醋酸钠溶液稀释,溶液中所有离子浓度都减小 |
| D.反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)在室温下可自发进行,则该反应的△H<0 |
【改编】下列物质性质与应用对应关系正确的是
| A.漂白粉在水溶液中能够生成次氯酸,可用于漂白纸张 |
| B.医用酒精具有强氧化性,可用于消毒杀菌 |
| C.二氧化硅不与强酸反应,可用制备光导纤维 |
| D.铜的金属活泼性比铁的弱,可在铁闸上装若干铜块以减缓其腐蚀 |
【改编】下列说法正确的是
| A.钢柱在水下部分比在空气与水交界处更容易腐蚀 |
| B.图1中,不论是否接通开关,铝均发生氧化反应,且在其表明均有气泡产生 |
| C.图1中,如果将稀盐酸换成浓硝酸,接通开关时铝电极周围有红棕色气体产生 |
| D.图2所示装置可发生反应的离子方程式为Fe+2Fe3+=3Fe2+,则a、b电极不可能是同种材料 |
下列有关钢铁腐蚀和防护的说法不正确的是
| A.自行车的钢圈上镀一层铬,防止生锈 |
| B.外加直流电源保护钢闸门时,钢闸门与电源的负极相连 |
| C.钢铁发生吸氧腐蚀的正极反应:2H2O +O2+4e-=== 4OH- |
| D.钢铁发生析氢腐蚀的负极反应:Fe – 3e-=== Fe3+ |
化学与人类社会的生产、生活有着密切联系。下列叙述中正确的是
| A.苹果放在空气中久置变黄和纸张久置变黄原理相似 |
| B.用活性炭为蔗糖脱色和用臭氧漂白纸浆,原理相似 |
| C.钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 |
| D.黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 |
化学与生产、生活密切相关,下列叙述中正确的是
| A.用活性炭为糖浆脱色和用双氧水漂白纸浆,其原理相同 |
| B.铜制品在潮湿空气中生锈,其主要原因是发生析氢腐蚀 |
| C.用NaHCO3和Al2(SO4)3溶液可以制作泡沫灭火剂 |
| D.从海水中可以制取NaCl,电解饱和NaCl溶液可以制取金属Na |
钢铁发生吸氧腐蚀时,负极上发生的电极反应是
| A.2H++2e-=H2 | B.Fe2++2e-=Fe |
| C.2H2O+O2+4e-=4OH- | D.Fe3++e-=Fe2+ |
Cl2、漂白液(有效成分为NaClO)在生产、生活中广泛用于杀菌、消毒.
(1)电解NaCl溶液生成Cl2的化学方程式是 。
(2)Cl 2溶于H2O、NaOH溶液即获得氯水、漂白液.
①干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是 。
②25℃,Cl 2与H2O、NaOH的反应如下: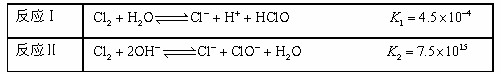
不直接使用氯水而使用漂白液做消毒剂的原因是 。
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为: 发生的电极反应式是 。
发生的电极反应式是 。
(4)研究漂白液的稳定性对其生产和保存有实际意义.30℃时,pH=11的漂白液中NaClO的质量百分含量随时间变化如下: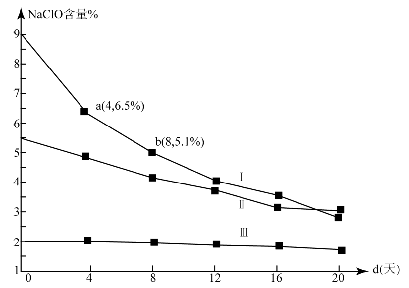
①分解速v(Ⅰ)、v(Ⅱ)的大小关系是 ,原因是 。
②NaClO分解的化学方程式是 。
③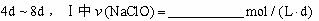 (常温下漂白液的密度约为1g / cm3,且变化忽略不计)
(常温下漂白液的密度约为1g / cm3,且变化忽略不计)
有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
| 实验 装置 |
 |
 |
 |
 |
| 部分实验现象 |
a极质量减小 b极质量增加 |
c极有气体产生 b极质量减轻 |
d极溶解c极有 气体产生 |
电流从a极 流向d极 |
由此可判断这四种金属的活动性顺序是
A.a>b>c>d B.b>c>d>a
C.d>a>b>c D.a>b>d>c