化学与生产、生活密切相关。下列叙述正确的是
| A.使用含有氯化钠的融雪剂会加快桥梁的腐蚀 |
| B.“海水淡化”可以解决“淡水供应危机”,向海水中加入净水机明矾可以使海水淡化 |
| C.煤经过气化、液化等物理变化可得到清洁燃料 |
| D.棉花、羊毛、木材和草类的主要成分都是纤维素 |
一定条件下,某含碳钢腐蚀情况与溶液pH的关系如下表。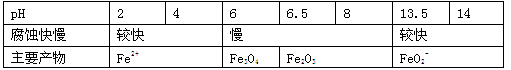
下列说法错误的是
| A.当pH<4时,碳钢主要发生析氢腐蚀 |
| B.当pH>6时,碳钢主要发生吸氧腐蚀 |
| C.当pH>14时,正极反应为O2 + 4H+ + 4e- =2H2O |
| D.将碱性溶液煮沸除去氧气后,碳钢腐蚀的速率会减缓 |
下列有关说法正确的是
| A.白铁(镀锌铁皮)镀层破损后铁仍不易腐蚀 |
B.CH3Cl(g)+Cl2(g) CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0 CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0 |
| C.MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)< Ksp(MnS) |
| D.合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率 |
I.肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。 已知在25℃、l0lkPA时,16gN2H4在氧气中完全燃烧生成氮气和H2O,放出热量312kJ。
(1)该条件下,N2H4完全燃烧的热化学方程式为
(2)传统制备肼的方法是以NAClO氧化NH3,制得肼的稀溶液,该反应的方程式为
II.钢铁工业是国家工业的基础。请回答钢铁腐蚀、防护过程中的有关问题。
(1)铁在潮湿的空气中容易被腐蚀,写出铁发生电化学腐蚀时,负极的电极反应式
(2)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。图中A、B、C、D四个区域,生成铁锈最多的是 (填字母)
(3)下列各个装置中铁棒被腐蚀由难到易的顺序是______(填字母)
下列事实不能用电化学理论解释的是
| A.镁片不用特殊方法保存 |
| B.镀锌的铁比镀锡的铁耐用 |
| C.轮船水线以下的船壳上装一定数量的锌块以保护船体 |
| D.纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 |
钢铁发生电化学腐蚀时,负极发生的反应是
| A.2H++2e—=H2 | B.2H2O+O2+4e—=4OH— |
| C.Fe一2e—=Fe2+ | D.4OH—一4e—=2H2O+O2 |
下列有关金属腐蚀与防护的说法正确的是
| A.纯银器表面在空气中因电化学腐蚀渐渐变暗 |
| B.当镀锡铁制品的镀层破损时,镶层仍能对铁制品起保护作用 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
.家用铁锅用水清洗放置后,出现红棕色的锈斑,在此过程中不发生的化学反应是
| A.4Fe(OH)2 + 2H2O + O2 ="=" 4Fe(OH)3 |
| B.2Fe + 2H2O + O2 ="=" 2Fe(OH)2 |
| C.2H2O + O2 + 4e-== 4OH- |
| D.Fe – 3e-== Fe3+ |
下图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液(呈酸性),各加入生铁块,放置一段时间。下列有关描述正确的是
| A.生铁块中的碳是原电池的正极,发生氧化反应 |
| B.红墨水柱两边的液面变为左低右高 |
| C.两试管中相同的负极的电极反应式是:Fe-3e-=Fe 3+ |
| D.a、b试管中均发生了化学能转化为电能的能量变化过程 |
下列事实不能用电化学理论解释的是
| A.锅炉的内壁镶嵌有一定量的锌块 | B.镀锌的铁制品比镀锡的铁制品耐用 |
| C.用铝质铆钉接铁板,铁不易被腐蚀 | D.铝片不用特殊方法保存 |
下列有关金属腐蚀与防护的说法不正确的是
| A.钢铁在弱碱性条件下发生电化学腐蚀的正极反应是:O2+2H2O+4e-===4OH- |
| B.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
(1)反应A+3B 2C+2D在四种不同情况下的反应速率分别如下:
2C+2D在四种不同情况下的反应速率分别如下:
该反应进行的由快到慢顺序为 (填序号)
(2)铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中如下图所示,则铁被腐蚀的速率由慢到快的顺序是(填序号)_______________。
如图各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是
| A.④>②>①>③ | B.②>①>③>④ |
| C.④>②>③>① | D.③>②>④>① |