山东省泰安市高三下学期一模理科综合化学试卷
下列说法正确的是
| A.石油的分馏、煤的干馏、电解质溶液导电均属于物理变化 |
| B.钢铁生锈主要发生吸氧腐蚀,镀锌铁皮镀层破损后对铁失去保护作用 |
| C.14C与12C互称同位素;O2与O3是氧元素的同素异形体 |
| D.SO2和CO2属于酸性氧化物,Na2O和Al2O3属于碱性氧化物 |
有机化合物M的结构简式为 ,关于M的说法正确的是
,关于M的说法正确的是
| A.分子式为C10H12O3 |
| B.1 molNa2CO3,最多能消耗l mol有机物M |
| C.1 molM与足量金属钠反应生成11.2 L气体(标准状况) |
| D.M能发生取代反应、氧化反应和加成反应 |
甲、乙、丙、丁4种短周期元素,在周期表中的位置关系如图所示。乙的原子序数大于丙,丁的原子序数与乙、丙原子序数之和相等。4种元素原子的最外层电子数之和为24。下列判断正确的是
| A.元素甲的简单气态氢化物稳定性比乙的强 |
| B.元素乙在周期表中的位置为第2周期、VIA族 |
| C.元素丙和元素丁的最高价氧化物对应的水化物均为强酸 |
| D.4种元素的简单阴离子半径从大到小顺序为:丁>乙>丙>甲 |
从下列实验事实所得出的相应结论正确的是
| |
实验事实 |
结论 |
| ① |
将某气体通入品红溶液中,品红溶液褪色 |
该气体一定是SO2 |
| ② |
将燃烧的镁条放入CO2中能继续燃烧 |
还原性:Mg>C |
| ③ |
NaHCO3溶液与Na[Al(OH)4]溶液混合产生白色沉淀 |
酸性:HCO3->Al(OH)3 |
| ④ |
常温下白磷可自然而氮气需在放电时才于氧气反应 |
非金属性:P>N |
| ⑤ |
某无色晶体加入氢氧化钠浓溶液中并加热,产生的气体能使湿润红色石蕊试纸变蓝 |
该晶体中一定有NH4+ |
A.②③⑤ B.①②③ C.③④⑤ D.①③⑤
下列说法正确的是
| A.用湿润的pH试纸测定溶液的pH,测定结果偏小,该溶液一定呈酸性 |
| B.“中和滴定”实验中,滴定管用蒸馏水洗净后,必须用待装液润洗后方可使用,锥形瓶用蒸馏水洗净后即可使用 |
| C.将碘水倒入分液漏斗,加入适量乙醇,振荡后静置,能将碘萃取到乙醇中 |
| D.将氢氧化钠稀溶液逐滴滴入氯化铁饱和溶液中,边滴边搅拌,可获得氢氧化铁胶体 |
下列说法中正确的是
| A.常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42-、NH4+能大量共存 |
| B.常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存 |
| C.一定温度下。l L 0.5 mol·L-1NH4C1溶液与2 L 0.25 mol·L-1NH4Cl溶液含NH4+物质的量相同 |
| D.反应ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq)说明Ksp(ZnS)>Ksp(CuS) |
向20 mL 0.1 mol·L-1氨水中逐滴加入0.1mol·L-1稀HCl,混合液pH与所加盐酸体积(V/mL)的关系如图所示。下列说法正确的是
A.在D点:c(NH4+)+c(NH3·H2O)>c(Cl-)
B.在C点,有V1>10,且c(NH4+)=c(Cl-)>c(OH-)=c(H+)
C.在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.由B到C的过程中,c(NH4+)/c(NH3·H2O)先增大后减小
对氮及其化合物的研究具有重要意义。
(1)在1 L密闭容器中,4 mol氨气在一定条件下分解生成氮气和氢气。2 min时反应吸收热量为46.1 kJ,此时氨气的转化率为25%。该反应的热化学方程式为_____________,这段时间内v(H2)=_________。
(2)298K时.在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g)
N2O4(g)  =-akJ·mol-1(a>0),N2O4的物质的量浓度随时间变化如图所示。达平衡时,N2O4的浓度为NO2的2倍。
=-akJ·mol-1(a>0),N2O4的物质的量浓度随时间变化如图所示。达平衡时,N2O4的浓度为NO2的2倍。
①298K时,该反应的化学平衡常数为_________(精确到0.01);
②下列情况不是处于平衡状态的是__________(填字母序号);
a.混合气体的密度保持不变
b.混合气体的颜色不再变化
c.气压恒定时
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol,n(N2O4)=1.2 mol,则此时v正____v逆(填“>”、“<”或“=”)。
(3)用氨气可设计成如图所示燃料电池,产生的X气体可直接排放到大气中。则a电极电极反应式为________________。
(4)t℃下,某研究人员测定NH3·H2O的电离常数为1.8×10-5。NH4+的水解常数为1.5×10-8,则该温度下水的离子积常数为___________,请判断t_____25℃(填“>”、“<”或“=”)。
铁、铝及其化合物的应用十分广泛,请回答:
(1)在实验室中,硝酸铝必须与可燃物分开存放,是因为硝酸铝具有____________(填字母序号)。
A.可燃性 B.氧化性 C.还原性
(2)已知:当Al(NO3),溶液中pH>3时,铝元素有多种存在形态,如A13+、[Al(OH)]2+、[Al(OH)2]+等,各形态之间可相互转化,写出该溶液中[Al(OH)]2+转化为[Al(OH)2]+的离子方程式_________________。
(3)氯化铁溶液常用作印刷电路铜板的腐蚀剂,反应的离子方程式为___________;从腐蚀废液中回收金属铜还需要的试剂是__________。
(4)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160 mL5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L氢气(标准状况),溶液中铁元素的存在形式为________(填离子符号),检验该离子的实验操作、现象和结论是_________;参加反应的铁粉的质量为______________。
硫酰氯(SO2Cl2)是一种化工原料,有如下有关信息:
常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气。氯化法是合成硫酰氯的常用方法,实验室合成反应和实验装置如下: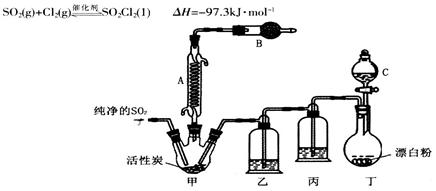
回答下列问题:
(1)仪器A的名称为______,甲中活性炭的作用是______,B中加入的药品是______。实验时从仪器C中放出溶液的操作方法是________。
(2)装置丁中发生反应的离子方程式为___________。用亚硫酸钠固体和浓硫酸制备二氧化硫气体时,如要控制反应速度,下图中可选用的发生装置是________(填写字母)。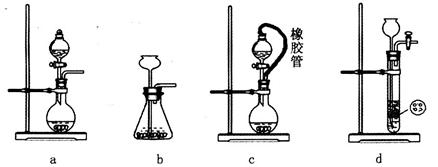
(3)氯磺酸(C1SO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_________________,分离产物的方法是_________。
(4)若缺少装置乙,氯气和二氧化硫可能发生反应的化学方程式为_______。为提高本实验中硫酰氯的产率,在实验操作中还需要注意的事项有(只答一条即可)_______。
【化学——化学与技术】火山喷发所产生的硫磺可用于生产重要的化工原料——硫酸。某企业用下图所示的工艺流程生产硫酸:
请回答下列问题:
(1)①为充分利用反应放出的热量,转化器中应安装______(填设备名称)。吸收塔中填充有许多瓷管,其作用是________;
②为使硫磺充分燃烧,经流量计l通入燃烧室的氧气过量50%。为提高SO2转化率,经流量计2的氧气量为转化器中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计l和流量计2的空气体积比应为______。b管排出的尾气的处理方法是________.
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是_________(填字母序号)。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废气减少 D.不需要使用催化剂
(2)硫酸的用途非常广泛;其中可应用于下列哪些方面__________(填字母序号)。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式___________________________
【化学—物质结构与性质】
碳是形成化合物种类最多的元素。
(1)C、N、O三种元素的第一电离能由大到小的顺序为______,碳的最简单气态氢化物中心原子的杂化类型为___________。
(2)类肉素[(SCN)2]的结构式为N C—S—S—C
C—S—S—C N。其分子中
N。其分子中 键和
键和 键的个数比为__________;该物质对应的酸有两种,理论上硫氰酸(H—S—C
键的个数比为__________;该物质对应的酸有两种,理论上硫氰酸(H—S—C N)的沸点低于异硫氰酸(H—N=C=S)的沸点,其原因是___________________。
N)的沸点低于异硫氰酸(H—N=C=S)的沸点,其原因是___________________。
(3)位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同的元素,其基态原子的价层电子排布式为 ____________。
(4)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能,其晶胞结构如图所示(其中·为碳原子,○为硅原子)。每个碳原子周围与其距离最近的硅原子有_____个;设晶胞边长为a cm,密度为b g·cm-3,则阿伏加德罗常数可表示为__________(用含a、b的式子表示).
【化学——有机化学基础】
下述反应是有机合成中常见的增长碳链的方法:
(1)有关化合物I的说法正确的是________。
| A.可发生取代、氧化等反应 |
| B.1mol化合物I最多能与4mol H2加成 |
| C.易溶于水、乙醇等溶剂 |
| D.属于芳香族化合物 |
(2)化合物Ⅱ的分子式为__________,lmol化合物Ⅱ与NaOH溶液反应最多消耗_____________mol NaOH.
(3)化合物III可与乙酸制备化合物Ⅱ,写出符合下列要求的III的同分异构体的结构简式______________.
a:遇FeCl3溶液显紫色 b:核磁共振氢谱有3组峰
(4)利用此增长碳链的方法,写出以甲苯为原料,制备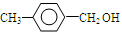 的化学方程式_____________________,_____________________。
的化学方程式_____________________,_____________________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号