下列各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是
| A.②>①>③>④ | B.④>②>①>③ | C.④>②>③>① | D.③>②>④>① |
【改编】下列叙述的原因不是由于原电池造成的是
| A.铁与酸反应滴加硫酸铜后反应加快 |
| B.金属在潮湿空气中更容易腐蚀 |
| C.镀锡铁镀层破损后腐蚀加快 |
| D.浓硝酸比稀硝酸更能氧化金属铜 |
下列说法正确的是
| A.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
| B.已知AgCl的Ksp=1.8×10-10、Ag2CrO4的Ksp=1.2×10-12,所以相同温度下AgCl的溶解度大于Ag2CrO4 |
| C.常温下,将pH =8的醋酸钠溶液稀释,溶液中所有离子浓度都减小 |
| D.反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)在室温下可自发进行,则该反应的△H<0 |
下列与金属腐蚀有关的说法正确的是( ) 
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
生活中的问题常涉及到化学知识,下列叙述中正确的是
| A.硫酸钡是一种难溶于水和酸的盐,可用作X光透视肠胃的药剂 |
| B.使用明矾可以对水进行消毒、杀菌 |
| C.铁制品在干燥的空气中易生锈 |
| D.棉花、蚕丝和人造丝的主要成分是纤维素 |
原电池与电解池在生活和生产中有着广泛应用。下列有关判断中错误的是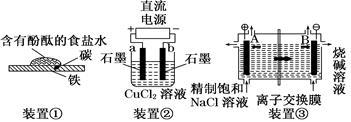
| A.装置①研究的是金属的吸氧腐蚀,Fe上的反应为Fe-2e===Fe2+ |
| B.装置②研究的是电解CuCl2溶液,它将电能转化为化学能 |
| C.装置③研究的是电解饱和食盐水,电解过程中B极上发生氧化反应 |
| D.三个装置中涉及的主要反应都是氧化还原反应 |
有关下列图像的说法正确的是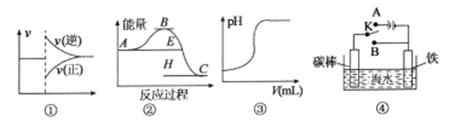
| A.图①可以表示,某化学平衡体系改变温度后反应速率随时间的变化 |
| B.根据图②判断,物质A反应生成物质C的△H>O |
| C.图③表示向一定量的硫酸溶液中滴加一定浓度氢氧化钠溶液时的pH变化 |
| D.图④中开关K置丁A或B处均可减缓铁的腐蚀 |
下列有关原电池和金属腐蚀的说法错误的是
| A.普通锌锰干电池碳棒是负极,锌片是正极 |
| B.盛水的铁器,在空气与水交界处更容易锈蚀 |
| C.为防止金属的腐蚀可在金属表面涂油漆、油脂 |
| D.用盐酸与锌反应制取氢气,含有杂质的锌比纯锌产生氢气速度快 |
下列现象或反应的原理解释正确的是
| |
现象或反应 |
原理解释 |
| A. |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝箔对熔化的铝有较强的吸附作用 |
| B. |
合成氨反应需在高温条件下进行 |
该反应为吸热反应 |
| C. |
镀层破损后,镀锡铁比镀锌铁易腐蚀 |
锡比锌活泼 |
| D. |
2CO=C+O2在任何条件下均不能自发进行 |
该反应△H>0,△S<0 |
[双选题]下列说法正确的是( )
| A.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀 |
| B.原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐 蚀 |
| C.钢铁电化学腐蚀的两种类型主要区别在于水膜的酸性不同,引起的正极反应不同 |
| D.无论哪种类型的腐蚀,其实质都是金属被氧化 |
下列有关金属腐蚀与防护的说法正确的是( )
| A.纯银器表面在空气中因化学腐蚀渐渐变暗 |
| B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.在海轮外壳连接银块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
生活中下列处理方法正确的是
| A.蚂蚁叮咬的红肿处涂沫苯酚止痒 | B.冬天在汽车水箱中加乙二醇抗冻 |
| C.纺织品上的油腻用烧碱溶液清洗 | D.把铁器具浸入水隔绝空气防生锈 |
下列与金属腐蚀有关的说法正确的是
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |