下列金属防腐的措施中,使用外加电流的阴极保护法的是
| A.水中的钢闸门连接电源的负极 | B.金属护拦表面涂漆 |
| C.汽水底盘喷涂高分子膜 | D.地下钢管连接镁块 |
下列有关金属腐蚀与防护的说法不正确的是
| A.钢铁在弱碱性条件下发生电化学腐蚀的正极反应是:O2+2H2O+4e-===4OH- |
| B.当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
下列有关说法正确的是
| A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 |
| B.2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0 |
| C.用锡焊接的铁质器件,焊接处易生锈 |
| D.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
下列叙述错误的是( )
| A.废弃的干电池不能随意丢弃,但可以土埋处理 |
| B.马口铁(镀锡铁)镀层破损后即失去保护作用 |
| C.不能将铁制自来水管与铜制水龙头连接使用 |
| D.电化学腐蚀过程中存在电极反应,产生微电流 |
如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是 
| A.生铁块中的碳是原电池的正极 |
| B.红墨水水柱两边的液面变为左低右高 |
| C.两试管中相同的电极反应式是Fe-2e-===Fe2+ |
| D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 |
下图可设计成多种用途的电化学装置。下列分析正确的是
| A.当a和b用导线连接时,溶液中的SO42-向铜片附近移动 |
| B.将a与电源正极相连可以保护锌片,这叫牺牲阳极的阴极保护法 |
| C.当a和b用导线连接时,铜片上发生的反应为:2H++2e →H2↑ |
| D.a和b用导线连接后,电路中通过0.02mol电子时,产生0.02mol气体 |
下列与金属腐蚀有关的说法,正确的是
| A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图2中,发生吸氧腐蚀 |
| C.图3中,燃烧灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 |
| D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁相当于原电池的正极 |
有关下列图像的说法正确的是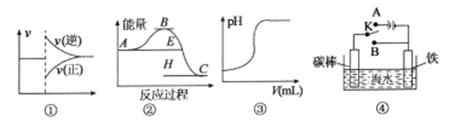
| A.图①可以表示,某化学平衡体系改变温度后反应速率随时间的变化 |
| B.根据图②判断,物质A反应生成物质C的△H>O |
| C.图③表示向一定量的硫酸溶液中滴加一定浓度氢氧化钠溶液时的pH变化 |
| D.图④中开关K置丁A或B处均可减缓铁的腐蚀 |
下列有关原电池和金属腐蚀的说法错误的是
| A.普通锌锰干电池碳棒是负极,锌片是正极 |
| B.盛水的铁器,在空气与水交界处更容易锈蚀 |
| C.为防止金属的腐蚀可在金属表面涂油漆、油脂 |
| D.用盐酸与锌反应制取氢气,含有杂质的锌比纯锌产生氢气速度快 |
下列现象或反应的原理解释正确的是
| |
现象或反应 |
原理解释 |
| A. |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝箔对熔化的铝有较强的吸附作用 |
| B. |
合成氨反应需在高温条件下进行 |
该反应为吸热反应 |
| C. |
镀层破损后,镀锡铁比镀锌铁易腐蚀 |
锡比锌活泼 |
| D. |
2CO=C+O2在任何条件下均不能自发进行 |
该反应△H>0,△S<0 |
据报道,全球每年发生金属腐蚀而造成的直接经济损失达数千亿美元。下列各电极反应
式中,能表示铁的电化学腐蚀的是
①Fe-2e-=Fe2+
②2H++2e-=H2↑
③Fe-3e-=Fe3+
④2H2O+O2+4e-=4OH-
⑤4OH--4e-=2H2O+O2↑
| A.①②⑤ | B.②③④ | C.①②④ | D.①③⑤ |
下图各容器中盛有海水,铁在其中被腐蚀时由快到满的顺序是
| A.③>②>④>① | B.②>①>③>④ |
| C.④>②>③>① | D.④>②>①>③ |
下面两套实验装置,都涉及金属的腐蚀反应,假设其中的金属块和金属丝都是足量的。请同学们仔细观察,
下列叙述正确的是 ( )
| A.装置Ⅰ在反应过程中自始至终只生成红棕色气体 |
| B.装置Ⅱ开始阶段铁丝只发生析氢腐蚀 |
| C.装置Ⅱ在反应过程中能产生氢气 |
| D.装置Ⅰ在反应结束时溶液中的金属阳离子只有Cu2+ |
如图所示的装置中,金属a能从酸中置换出H2,b为碳棒,关于此装置的各种叙述中不正确的是( )
| A.碳棒上有气体放出,溶液pH值变大 |
| B.a是正极,b是负极 |
| C.导线中有电子流动,电子从a极到b极 |
| D.a极上发生了氧化反应 |