下列关于金属腐蚀的叙述正确的是
| A.金属(M表示金属) 被腐蚀的本质是: M n+ + ne- = M |
| B.金属不可能在碱性环境中发生电化学腐蚀 |
| C.镀锌铁的镀层破损后,镀层仍能对铁起保护作用 |
| D.钢管与外加直流电源的正极相连,以保护它不受腐蚀 |
下列各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是
| A.②>①>③>④ | B.④>②>①>③ | C.④>②>③>① | D.③>②>④>① |
【改编】下列叙述的原因不是由于原电池造成的是
| A.铁与酸反应滴加硫酸铜后反应加快 |
| B.金属在潮湿空气中更容易腐蚀 |
| C.镀锡铁镀层破损后腐蚀加快 |
| D.浓硝酸比稀硝酸更能氧化金属铜 |
打开下图所示装置中的止水夹,一段时间后,可能观察到的现象是
| A.烧杯中有气泡产生 | B.试管内有黄绿色气体产生 |
| C.铁丝网的表面产生锈迹 | D.烧杯内溶液变红色 |
下列说法正确的是
| A.氯碱工业中,烧碱在阳极区生成 |
| B.电解熔融氯化铝冶炼金属铝 |
| C.电镀时,用镀层金属作阳极 |
| D.将钢闸门与外电源正极相连,可防止其腐蚀 |
如图,向还原铁粉中加入少量的炭粉,混合均匀后,撒入内壁用NaCl溶液润湿过的具支试管中,塞紧橡皮塞。几分钟后,打开止水夹,观察到导管中水柱上升。对此过程所作的分析正确的是
| A.铁粉在电化学腐蚀过程中作正极 | B.炭粉被氧化 |
| C.发生了吸氧腐蚀 | D.发生了析氢腐蚀 |
将炭粉和铁粉均匀混合,撒入内壁分别用氯化钠溶液和稀醋酸溶液润湿过的具支试管中,并按下图装置好仪器,观察下图,示意正确的是
有关下列图像的说法正确的是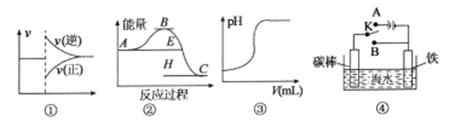
| A.图①可以表示,某化学平衡体系改变温度后反应速率随时间的变化 |
| B.根据图②判断,物质A反应生成物质C的△H>O |
| C.图③表示向一定量的硫酸溶液中滴加一定浓度氢氧化钠溶液时的pH变化 |
| D.图④中开关K置丁A或B处均可减缓铁的腐蚀 |
下列有关原电池和金属腐蚀的说法错误的是
| A.普通锌锰干电池碳棒是负极,锌片是正极 |
| B.盛水的铁器,在空气与水交界处更容易锈蚀 |
| C.为防止金属的腐蚀可在金属表面涂油漆、油脂 |
| D.用盐酸与锌反应制取氢气,含有杂质的锌比纯锌产生氢气速度快 |
下列现象或反应的原理解释正确的是
| |
现象或反应 |
原理解释 |
| A. |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝箔对熔化的铝有较强的吸附作用 |
| B. |
合成氨反应需在高温条件下进行 |
该反应为吸热反应 |
| C. |
镀层破损后,镀锡铁比镀锌铁易腐蚀 |
锡比锌活泼 |
| D. |
2CO=C+O2在任何条件下均不能自发进行 |
该反应△H>0,△S<0 |
如图所示的装置中,金属a能从酸中置换出H2,b为碳棒,关于此装置的各种叙述中不正确的是( )
| A.碳棒上有气体放出,溶液pH值变大 |
| B.a是正极,b是负极 |
| C.导线中有电子流动,电子从a极到b极 |
| D.a极上发生了氧化反应 |
下列与金属腐蚀有关的说法正确的是( )
| A.图a中,插入海水中的铁棒越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
下列金属防腐的措施中,使用外加电流的阴极保护法的是
| A.水中的钢闸门连接电源的负极 |
| B.金属护拦表面涂漆 |
| C.汽车底盘喷涂高分子膜 |
| D.地下钢管连接镁块 |
下图小试管内为红墨水,具支试管内盛有pH=4久置的雨水和生铁片。实验观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。下列说法正确的是
| A.生铁片中的碳是原电池的负极,发生还原反应 |
| B.雨水酸性较强,生铁片始终发生析氢腐蚀 |
| C.墨水回升时,碳电极反应式为O2+2H2O+4e-===4OH- |
| D.具支试管中溶液酸性增强 |