利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,
如废铝罐和碳棒,食盐水等材料制作可用于驱动玩具的电池。上述电池工作时,有关说法正确的是
| A.铝罐将逐渐被腐蚀 |
| B.碳棒上发生的反应为:O2+4e-===2O2- |
| C.碳棒应与玩具电机的负极相连 |
| D.该电池工作一段时间后碳棒的质量会减轻 |
下列有关说法正确的是
| A.白铁(镀锌铁皮)镀层破损后铁仍不易腐蚀 |
B.CH3Cl(g)+Cl2(g) CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0 CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0 |
| C.MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)< Ksp(MnS) |
| D.合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率 |
下列关于金属的保护的说法中正确的是
| A.以铝为阴极极,可以在铝表面生成一层致密的氧化膜 |
| B.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| C.生铁(铁碳合金)比纯铁耐酸能力更强 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
碳素钢是含碳的铁合金。在潮湿的空气中,碳素钢表面吸附了一层薄薄的水膜。如果水膜中溶解了酸性气体,就使水膜里的H+增多,这时C、Fe和酸性水膜就形成了原电池。在无数个微小的原电池中
A.C是正极,发生氧化反应 B.C是负极,发生氧化反应
C.Fe是正极,发生还原反应 D.Fe是负极,发生氧化反应
钢铁发生电化学腐蚀时,负极发生的反应是
| A.2H++2e—=H2 | B.2H2O+O2+4e—=4OH— |
| C.Fe一2e—=Fe2+ | D.4OH—一4e—=2H2O+O2 |
下列金属防腐的措施中,使用外加电流的阴极保护法的是
| A.地下钢管连接镁块 |
| B.金属护拦表面涂漆 |
| C.枪炮表面涂上一层油 |
| D.水中的钢闸门连接电源的负极 |
有关下列图像的说法正确的是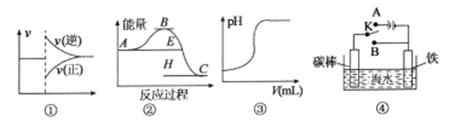
| A.图①可以表示,某化学平衡体系改变温度后反应速率随时间的变化 |
| B.根据图②判断,物质A反应生成物质C的△H>O |
| C.图③表示向一定量的硫酸溶液中滴加一定浓度氢氧化钠溶液时的pH变化 |
| D.图④中开关K置丁A或B处均可减缓铁的腐蚀 |
下列有关原电池和金属腐蚀的说法错误的是
| A.普通锌锰干电池碳棒是负极,锌片是正极 |
| B.盛水的铁器,在空气与水交界处更容易锈蚀 |
| C.为防止金属的腐蚀可在金属表面涂油漆、油脂 |
| D.用盐酸与锌反应制取氢气,含有杂质的锌比纯锌产生氢气速度快 |
下列现象或反应的原理解释正确的是
| |
现象或反应 |
原理解释 |
| A. |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝箔对熔化的铝有较强的吸附作用 |
| B. |
合成氨反应需在高温条件下进行 |
该反应为吸热反应 |
| C. |
镀层破损后,镀锡铁比镀锌铁易腐蚀 |
锡比锌活泼 |
| D. |
2CO=C+O2在任何条件下均不能自发进行 |
该反应△H>0,△S<0 |
下列与金属腐蚀有关的说法正确的是
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
关于下列各装置图的叙述中,不正确的是( )
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应式是Cu+2Fe3+====Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
下列说法正确的是
| A.常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0 |
| B.铜的金属活动性比铁弱,可在海轮外壳上装若干铜块以减缓船体的腐蚀速率 |
| C.其他条件不变,向纯水中加入盐酸或氢氧化钠都能抑制水的电离,降低水的离子积 |
| D.能与酸反应的氧化物,一定是碱性氧化物 |
将炭粉和铁粉均匀混合,撒入内壁分别用氯化钠溶液和稀醋酸溶液润湿过的具支试管中,并按下图装置好仪器,观察下图,示意正确的是