某课外活动小组,为研究金属的腐蚀和防护的原理,做了以下实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,按如右图所示的装置进行实验,过一段时间后观察。下列现象可能出现的是
| A.B中导气管中产生气泡 | B.B中导气管里形成一段水柱 |
| C.锥形瓶中溶液无色 | D.铁被腐蚀 |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
| A.铅蓄电池放电的正极电极反应式:PbO2 +4H++2e -==Pb2++2H2O |
| B.氢氧碱性燃料电池的负极反应式:O2 + 2H2O+ 4e- ="=" 4OH - |
| C.粗铜精炼时,与电源负极相连的是纯铜,电极反应式为:Cu2++2e- ="=" Cu |
| D.钢铁发生电化学腐蚀的正极反应式:Fe-2e - ="=" Fe2+ |
糕点(如月饼)包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
| A.脱氧过程是吸热反应,可降低温度,延长糕点保质期 |
| B.脱氧过程中铁作原电池正极,电极反应为:Fe—3e— =Fe3+ |
| C.脱氧过程中碳做原电池负极,电极反应为:2H2O + O2 + 4e—= 4OH— |
| D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
埋在地下的铸铁输油管道,在下列各种情况下,被腐蚀速率最慢的是
| A.在潮湿疏松的碱性土壤中 |
| B.在含铁元素较多的酸性土壤中 |
| C.在干燥致密不透气的土壤中 |
| D.在含碳粒较多,潮湿透气的中性土壤中 |
下图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
| A.生铁块中的碳是原电池的正极 |
| B.红墨水柱两边的液面变为左低右高 |
| C.两试管中相同的电极反应式是:Fe-2e-=Fe2+ |
| D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 |
下列有关叙述中正确的是
| A.常用热还原法来冶炼Mg、Al、Fe |
| B.人们常采用牺牲阳极保护法防止通讯电缆发生腐蚀 |
| C.合成氨中采取及时分离液态氨的目的是提高反应速率 |
| D.海带中含有碘元素,只需经过物理变化就可以得到碘单质 |
下列关于金属腐蚀的叙述正确的是
| A.金属(M表示金属) 被腐蚀的本质是: M n+ + ne- = M |
| B.金属不可能在碱性环境中发生电化学腐蚀 |
| C.镀锌铁的镀层破损后,镀层仍能对铁起保护作用 |
| D.钢管与外加直流电源的正极相连,以保护它不受腐蚀 |
下列各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是
| A.②>①>③>④ | B.④>②>①>③ | C.④>②>③>① | D.③>②>④>① |
【改编】下列叙述的原因不是由于原电池造成的是
| A.铁与酸反应滴加硫酸铜后反应加快 |
| B.金属在潮湿空气中更容易腐蚀 |
| C.镀锡铁镀层破损后腐蚀加快 |
| D.浓硝酸比稀硝酸更能氧化金属铜 |
有关下列图像的说法正确的是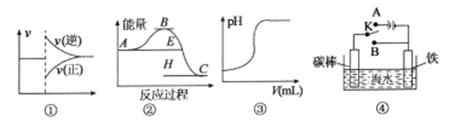
| A.图①可以表示,某化学平衡体系改变温度后反应速率随时间的变化 |
| B.根据图②判断,物质A反应生成物质C的△H>O |
| C.图③表示向一定量的硫酸溶液中滴加一定浓度氢氧化钠溶液时的pH变化 |
| D.图④中开关K置丁A或B处均可减缓铁的腐蚀 |
下列有关原电池和金属腐蚀的说法错误的是
| A.普通锌锰干电池碳棒是负极,锌片是正极 |
| B.盛水的铁器,在空气与水交界处更容易锈蚀 |
| C.为防止金属的腐蚀可在金属表面涂油漆、油脂 |
| D.用盐酸与锌反应制取氢气,含有杂质的锌比纯锌产生氢气速度快 |
下列现象或反应的原理解释正确的是
| |
现象或反应 |
原理解释 |
| A. |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝箔对熔化的铝有较强的吸附作用 |
| B. |
合成氨反应需在高温条件下进行 |
该反应为吸热反应 |
| C. |
镀层破损后,镀锡铁比镀锌铁易腐蚀 |
锡比锌活泼 |
| D. |
2CO=C+O2在任何条件下均不能自发进行 |
该反应△H>0,△S<0 |
下列说法正确的是
| A.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
| B.铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀 |
| C.铅蓄电池放电时的负极和充电时的阳极均发生还原反应 |
| D.在潮湿的碱性环境中,金属的电化学腐蚀主要是析氢腐蚀 |
下列叙述,其中正确的是
①电解池是将化学能转变成电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程相当于金属的“迁移”,可视为物理变化
| A.①②③④ | B.③④ | C.③④⑤ | D.④ |