在钢铁的吸氧腐蚀中,发生还原反应的电极上的进行的电极反应是
| A.4 OH- -4e-=2H2O+O2↑ | B.2H++2e-=H2↑ |
| C.2H2O+O2+4e-="4" OH- | D.Fe-2e-= Fe2+ |
下列说法不正确的是( )
| A.煤经过气化和液化等物理变化可以转化为清洁燃料 |
| B.侯氏制碱法的工艺过程,应用了物质溶解度的差异 |
| C.食品包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同 |
| D.甘氨酸和丙氨酸发生脱水反应,最多可生成4种二肽 |
下列做法不利于金属防护的是
| A.菜刀切菜后不洗净就放回刀架 | B.将钢铁制成不锈钢 |
| C.在铁塔的表面喷油漆 | D.埋在地下的钢管与锌块连接 |
有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中只有Z、Y能溶解;若将合金置于潮湿空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液作电解液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是 ( )
| A.Y>Z>W>X | B.Z>Y>W>X | C.W>Z>Y>X | D.X>Y>Z>W |
化学用语是学习化学的重要工具,下列化学用语中正确的是
A.Na2S的水解:S2-+ 2H2O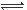 H2S + 2OH- H2S + 2OH- |
B.NaHCO3的电离:NaHCO3 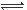 Na + + H+ + CO32- Na + + H+ + CO32- |
C.HSO3-的电离:HSO3- 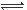 H+ + SO32- H+ + SO32- |
| D.钢铁的电化学腐蚀的负极反应式:Fe-3e-Fe3+ |
下列说法正确的是
| A.在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS) |
| B.在NaHS溶液中,加入少量CuCl2粉末产生黑色沉淀,则pH增大 |
| C.加热条件下并加入大量水促进TiCl4水解,以制备TiO2固体 |
| D.铜制器皿放置过程中会生成铜绿是因为发生了析氢腐蚀 |
如图所示的钢铁的析氢腐蚀与吸氧腐蚀中,下列说法正确的是( )

| A.碳表面发生氧化反应 |
| B.钢铁被腐蚀的最终产物为FeO |
| C.生活中钢铁制品的腐蚀以图①所示为主 |
| D.图②中,正极反应式为O2+4e-+2H2O===4OH- |
下列描述不符合生产、生活实际的是
| A.家用炒锅残留盐溶液时易发生吸氧腐蚀 |
| B.电解法精炼粗铜,用纯铜作阴极 |
| C.电解水制氢气时,用铜作阳极 |
| D.在镀件上电镀锌,用锌作阳极 |
下列关于金属腐蚀的说法中不正确的是
| A.金属腐蚀的本质是金属原子失去电子而被氧化 |
| B.金属腐蚀一般包括化学腐蚀和电化学腐蚀 |
| C.纯的金属一般难以发生电化学腐蚀 |
| D.钢铁在酸性环境中会发生吸氧腐蚀 |
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不会发生的化学反应是( )
| A.Fe-3e-===Fe3+ | B.2Fe+2H2O+O2===2Fe(OH)2 |
| C.2H2O+O2+4e-===4OH- | D.4Fe(OH)2+2H2O+O2===4Fe(OH)3 |
近年来AIST报告正在研制一种“高容量、低成本”锂一铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是
| A.通空气时,铜被腐蚀,表面产生CuO |
| B.放电时,Li+透过固体电解质向Cu极移动 |
| C.放电时,正极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH- |
| D.整个反应过程中,铜相当于催化剂 |
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为硬币制作时,钢芯应该做
| A.正极 | B.负极 | C.阳极 | D.阴极 |