钢铁发生电化腐蚀时,正极上发生的反应是
| A.2H++2e-=H2↑ | B.2H2O+O2+4e-=4OH- |
| C.Fe-2e-=Fe2+ | D.4OH--4e-=O2↑+2H2O |
下列关于金属腐蚀与防护的说法正确的是
| A.古代青铜文物在干燥环境中的腐蚀比潮湿环境中快 |
| B.当镀锌铁制品的镀层破损时,镀层不能对铁制品起保护作用 |
| C.将钢闸门与直流电源的正极相连可防止其被腐蚀 |
| D.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
下列拟采用的金属防腐措施,错误的是
| A.给金属衣架或电线外面包上一层塑料层 |
| B.给自行车钢圈镀上一层金属铬 |
| C.在轮船的外表面焊上一些铜块 |
| D.给铁栅栏表面涂上一层油漆 |
钢铁发生吸氧腐蚀时,正极上发生的电极反应是
| A.2H++2e-=H2 | B.Fe2++2e-=Fe |
| C.2H2O+O2+4e-=4OH- | D.Fe3++e-=Fe2+ |
有关金属腐蚀的叙述正确的是
| A.生铁抗腐蚀能力比纯铁强 |
| B.钢瓶在储存液氯前彻底干燥可减缓腐蚀 |
| C.水库铁闸与直流电源正极相连可减缓腐蚀 |
| D.常温下浓硝酸比浓盐酸更易使铁腐蚀 |
下列叙述正确的是
| A.合成氨工业中,移走NH3可增大正反应速率,提高原料转化率 |
| B.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液 |
| C.将NO2、N2O4混合气体的体积压缩为原来的一半,则气体颜色加深 |
| D.牺牲阳极的阴极保护法和外加直流电的阴极保护法都是应用电解原理 |
据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中负极主要发生的反应是
| A.2H++2e-=H2↑ | B.2H2O+O2+4e-=4OH- |
| C.Fe-2e-=Fe2+ | D.4OH--4e-=2H2O+O2↑ |
下列叙述正确的是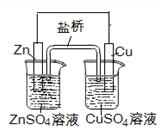
| A.电镀时,通常把待镀的金属制品作阳极 |
| B.上图Zn为负极,发生还原反应 |
| C.上图电子由Zn电极流向Cu电极,盐桥中的Cl-移向CuSO4溶液 |
| D.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为:O2+4H++4e-= 2H2O |
下列关于金属腐蚀的说法中不正确的是
| A.金属腐蚀的本质是金属原子失去电子而被氧化 |
| B.金属腐蚀一般包括化学腐蚀和电化学腐蚀 |
| C.纯的金属一般难以发生电化学腐蚀 |
| D.钢铁在酸性环境中会发生吸氧腐蚀 |
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不会发生的化学反应是( )
| A.Fe-3e-===Fe3+ | B.2Fe+2H2O+O2===2Fe(OH)2 |
| C.2H2O+O2+4e-===4OH- | D.4Fe(OH)2+2H2O+O2===4Fe(OH)3 |
近年来AIST报告正在研制一种“高容量、低成本”锂一铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是
| A.通空气时,铜被腐蚀,表面产生CuO |
| B.放电时,Li+透过固体电解质向Cu极移动 |
| C.放电时,正极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH- |
| D.整个反应过程中,铜相当于催化剂 |
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为硬币制作时,钢芯应该做
| A.正极 | B.负极 | C.阳极 | D.阴极 |