(1)某兴趣小组利用如图所示装置进行实验。
闭合K1,U形管内除电极上有气泡外,还可观察到的现象是 ;在A注射器收集到的气体是 ,阳极电极反应式为 。当电路中转移0.001mol电子时,B注射器最多可以收集到气体 mL(折算为标准状况)。
(2)某兴趣小组利用如图所示装置进行实验,对钢铁的电化学腐蚀原理进行探究。
①首先向锥形瓶内加入铁粉和碳粉的混合物、氯化钠溶液,半分钟后发现U型管内左侧液面高过右侧液面,这现象说明,在中性条件下发生 腐蚀,请写出该反应的电极反应方程式
负极: 正极:
②清洗锥形瓶后,重新加入铁粉和碳粉的混合物,加入1mol/L醋酸溶液,半分钟后发现U型管内左侧液面高过右侧液面,这一现象说明,前半分钟 腐蚀占优势,请写出这时正极主要的电极反应方程式 ,5分钟后发现U型管内右侧液面高过左侧液面,此时 腐蚀占据优势,请写出此时正极的电极反应方程式 。
铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为 。
②图中A、B、C、D四个区域,生成铁锈最多的是 (填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为 。
②步骤II中发生反应:4Fe(NO3) 2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 。
③上述生产流程中,能体现“绿色化学”思想的是 (任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x molCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:
分析图像,以下结论错误的是
| A.析氢腐蚀和吸氧腐蚀的速率一样快 |
| B.在酸性溶液中生铁可能发生吸氧腐蚀 |
| C.溶液pH≤2时,生铁发生析氢腐蚀 |
| D.两溶液中负极反应均为:Fe – 2e===Fe2+ |
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表中②的实验目的:
| 编号 |
实验目的 |
碳粉/g |
铁粉/g |
醋酸/% |
| ① |
为以下实验作参照 |
0.5 |
2.0 |
90.0 |
| ② |
|
0.5 |
2.0 |
36.0 |
| ③ |
碳粉质量的影响 |
0.2 |
2.0 |
90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了吸氧腐蚀;此时,碳粉表面发生了 (填“氧化”或“还原”)反应,其电极反应式是: 。
(3)该小组对图中0~t1时压强变大的原因提出如下假设。
请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二: ;
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤及结论: 。
按如图所示装置进行下列不同的操作,
其中不正确的是
| A.铁腐蚀的速度由大到小的顺序是:只接通K1>只闭合K3>都断开>只闭合K2 |
| B.只接通K1,一段时间后,U形管中出现白色沉淀 |
| C.只接通K2,U形管左、右两端液面均下降 |
| D.先只接通K1,一段时间后,漏斗液面上升,然后再只接通K2,漏斗液面下降 |
电化学原理在日常生活和工农业生产中发挥着重要作用。钢铁生锈现象随处可见,钢铁的电化腐蚀原理如图所示:
(1)写出石墨电极的电极反应_________________________;
(2)将该装置作简单修改即可成为钢铁电化学防护的装置,请在上图虚线框内所示位置作出修改,并用箭头标出导线中电子流动方向且完成以下问题
①简单修改后的该防护装置的名称为__________________________________
写出修改后石墨电极的电极反应式____________________________________;
②_______极(填“正极”“负极”“阳极”“阴极”)附近溶液的pH增大;
③检验阳极产物的方法是_____________________________________________;
④修改后的装置共收集到标准状况下的气体11.2 L时,则有______mol电子发生转移,假设溶液的体积为200ml,则此时溶液中OH-的物质的量浓度为________mol/L
(10分)某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图所示)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
| 编号 |
实验目的 |
炭粉/g |
铁粉/g |
醋酸/% |
| ① |
为以下实验作参照 |
0.5 |
2.0 |
90.0 |
| ② |
醋酸浓度的影响 |
0.5 |
|
36.0 |
| ③ |
|
0.2 |
2.0 |
90.0 |
(2)编号①实验测得容器中的压强随时间的变化如图(a)所示。t2时,容器中压强明显小于起始压强,其原因是铁发生了________腐蚀,请在图(b)中用箭头标出发生该腐蚀时电子的流动方向;此时,炭粉表面发生了________(填“氧化”或“还原”)反应,其电极反应式是__________。

(a) (b)
(3)该小组对图(a)中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:________;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,补全实验步骤和结论。
实验步骤和结论
①药品用量和操作同编号①实验(多孔橡皮塞增加进、
出导管);
②通入氩气排净瓶内空气;
③ 。
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,有3 mol FeS2参加反应,转移________mol电子。
6SO2+Fe3O4,有3 mol FeS2参加反应,转移________mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为_____________;从腐蚀废液回收得到金属铜,还需要的试剂是________。
(3)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是______________________________________ 。
(4)钢铁的电化腐蚀原理如图所示,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在图中虚线框内作出修改,并用箭头标出电子流动方向。
在构成宇宙万物的一百多种元素中,金属约占了80%,它们在现代工业和新材料、新技术研究中具有至关重要的意义。现有a、b、c、d四种金属元素,a是人体内含量最多的金属元素,b是地壳中含量最多的金属元素,c是海水中含量最多的金属元素,d是人类冶炼最多的金属元素。
(1)元素a在元素周期表中的位置为 ;
(2)下列可以证明b、c金属性强弱的是 。
A.最高价氧化物对应水化物的溶解性:b c B.单质与水反应的剧烈程度:b
c B.单质与水反应的剧烈程度:b c
c
C.相同条件下,氯化物水溶液的pH值:b c D.c可以从b的氯化物水溶液中置换出b
c D.c可以从b的氯化物水溶液中置换出b
(3)b的阳离子与Yn-的电子数相同, Y所在族各元素的氢化物的水溶液均显酸性,则该族元素的氢化物中沸点最低的是________。(填化学式)
(4)b电池性能优越,b一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
①该电池的总反应化学方程式为_______________________________________________;
②用b电池电解CuSO4溶液(电极均为铂电极),通电一段时间后,一极上析出红色固体,另一极的电极反应式为______________________,此时向溶液中加入8gCuO固体后可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为___________L。
(5)人类冶炼d的时候一般得到的是d的合金,潮湿环境中其表面会产生一层水膜,从而发生腐蚀。下列关于该腐蚀的说法正确的是 。
A.腐蚀过程中,一定会有气体放出
B.腐蚀过程中,水膜的碱性会增强
C.在酸性条件下,负极的电极反应式为:2H++2e-→H2
D.与电源的负极相连,可以防止发生这种腐蚀
(6)d单质在高温下会与水蒸气反应生成一种黑色固体和一种易燃性气体,且每生成1 mol该易燃气体放出37.68 kJ热量,请写出此反应的热化学方程式: 。
(1)利用如图装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。若X为锌,开关K置于M处,该电化学防护法称为 。
(2)肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,通入肼的一极为 极,该极的电极反应式是 ,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。
(3)碘被称为 “智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,可通过电解制备碘酸钾。(阴、阳两极均用惰性电极,阴极室与阳极室用阳离子交换膜隔开)请回答下列问题:电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为 。
(1)用l体积SO2和3体积氧气混合,在450℃以上通过V2O5催化剂,发生如下反应: 一段时间后达到平衡,若此时同温同压下测得反应前后混合气体的密度比为0.9:1,则SO2平衡转化率为_________%,
一段时间后达到平衡,若此时同温同压下测得反应前后混合气体的密度比为0.9:1,则SO2平衡转化率为_________%,
(2)在25℃时,有pH=m(m≤6)的盐酸 L和pH="n" (n>8)的NaOH溶液
L和pH="n" (n>8)的NaOH溶液 L。二者混合恰好完全中和。问:若n+m=13时,则
L。二者混合恰好完全中和。问:若n+m=13时,则 /
/ =___________.
=___________.
(3)利用下图装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于____处。
若X为锌,开关K置于M处,该电化学防护法称为 。
有关中学常见元素X、Y、Z、D、E的信息如下:
| 元素 |
有关信息 |
| X |
元素主要化合价为-2 |
| Y |
所在主族序数与所在周期序数之差为4 |
| Z |
与X同主族,其单质在X的单质中燃烧,发出蓝紫色火焰 |
| D |
最高价氧化物既能溶于强酸又能溶于强碱 |
| E |
单质是生活中常见金属,其制品在潮湿的空气中易被腐蚀或损坏 |
用化学用语回答下列问题:
(1)X在元素周期表中的位置 ;画出Y的离子结构示意图 ;
(2)Y、Z的最高价氧化物对应的水化物酸性较强的是(填化学式) ;
X、Y、D形成的简单离子的半径由大到小为(填离子符号) 。
(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为 ,D的最高价氧化物溶于强碱的离子方程式 。
(4)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号) 。
①保存EY2溶液时,需向溶液中加入少量E单质
②EY2只能通过置换反应生成,EY3只能通过化合反应生成
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④向煮沸的NaOH溶液中滴加几滴饱和EY3溶液,可以制得胶体
(5)E单质在潮湿空气中被腐蚀的正极反应式为 。
铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。

①该电化腐蚀称为。
②图中四个区域,生成铁锈最多的是(填字母)。
(2)用废铁皮制取铁红()的部分流程示意图如下:

①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为。
②步骤Ⅱ中发生反应:,反应产生的
又将废铁皮中的铁转化为
,该反应的化学方程式为。
③上述生产流程中,能体现"绿色化学"思想的是(任写一项)。
(3)已知t℃时,反应的平衡常数
=0.25。
①t℃时,反应达到平衡时=。
②若在1 密闭容器中加入0.02
,并通入
,t℃时反应达到平衡。此时
转化率为50%,则
=。
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
| 编号 |
实验目的 |
碳粉/ |
铁粉/ |
醋酸/% |
| ① |
为以下实验作参照 |
0.5 |
2.0 |
90.0 |
| ② |
醋酸浓度的影响 |
0.5 |
|
36.0 |
| ③ |
0.2 |
2.0 |
90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。时,容器中压强明显小于起始压强,其原因是铁发生了腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了("氧化"或"还原")反应,其电极反应式是。
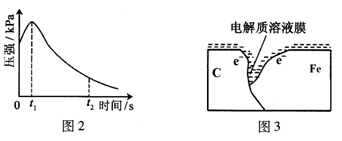
(3)该小组对图2中0~时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
| 实验步骤和结论(不要求写具体操作过程): |
液化石油气中常存在少量有毒气体羰基硫(COS),必须将其脱除以减少环境污染和设备腐蚀。完成下列填空。
(1)写出羰基硫的电子式 ,羰基硫分子属于 (选填“极性”、“非极性”)分子。
(2)下列能说明碳与硫两元素非金属性相对强弱的是 。
a.相同条件下水溶液的pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.CS2中碳元素为+4价,硫元素为-2价
(3)羰基硫在水存在时会缓慢水解生成H2S,对钢铁设备产生电化学腐蚀。写出正极的电极反应式 ,负极的反应产物为 (填化学式)。
为除去羰基硫,工业上常采用催化加氢转化法,把羰基硫转化为H2S再除去:COS + H2 CO + H2S
CO + H2S
(4)已知升高温度,会降低羰基硫的转化率。则升高温度,平衡常数K ,反应速率 (均选填“增大”、“减小”、“不变”)。
(5)若反应在恒容绝热密闭容器中进行,能说明该反应已达到平衡状态的是 。
a.容器内气体密度保持不变 b.容器内温度保持不变
c.c(H2)=c(H2S) d.υ(H2)正=υ(H2S)正
(6)已知该反应的平衡常数很大,说明 。