对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)利用如图装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应置于________处。若X为锌,开关K置于M处,该电化学防护法称为__________________。
(2)以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是_________________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的________。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为_________________。
取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是____________________。
(3)镀铜可防止铁制品腐蚀,电镀时阳极材料为________________,用铜而不用石墨作阳极的原因是______________________。
某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是 。
(2)已知:
20℃时溶解度/g
| CaCO3 |
CaSO4 |
Mg(OH)2 |
MgCO3 |
| 1.4×10-3 |
2.55×10-2 |
9×10-4 |
1.1×10-2 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程 。
(3)在步骤Ⅱ中:
① 被除掉的水垢除铁锈外,还有 。
② 清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因 。
(4)步骤Ⅲ中,加入Na2SO3的目的是 。
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe2O3保护膜。
① 完成并配平其反应的离子方程式:

②下面检测钝化效果的方法合理的是 。
a. 在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b. 在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c. 在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
d. 在炉面上滴加浓HNO3,观察出现红棕色气体的时间
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2===2Fe(OH)2。以下说法正确的是
| A.负极发生的反应为:Fe-2e-===Fe2+ |
| B.正极发生的反应为:2H2O+O2+2e-===4OH- |
| C.原电池是将电能转变为化学能的装置 |
| D.钢柱在水下部分比在水面处更容易腐蚀 |
若在铜片上镀银时,下列叙述正确的是
①将铜片接在电源的正极上,
②将银片接在电源的正极上,
③在铜片上发生的反应是:Ag+ + e-= Ag,
④在银片上发生的反应是:4OH-= O2↑+ 2H2O+4e-,
⑤需用CuSO4溶液作电解液,
⑥需用AgNO3溶液作电解液
| A.①③⑥ | B.②③⑥ | C.①④⑤ | D.②③④⑥ |
食品包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
| A.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
| B.脱氧过程中铁作原电池负极,电极反应为:Fe-3e-=Fe3+ |
| C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- |
| D.加入脱氧剂的目的是因为该反应是吸热过程,可降低温度,延长食品保质期 |
利用下图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
| A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 |
| B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 |
| C.电镀工业中,X是待镀金属,Y是镀层金属 |
| D.外加电流的阴极保护法中,Y是待保护金属 |
一定条件下,某含碳钢腐蚀情况与溶液pH的关系如下表。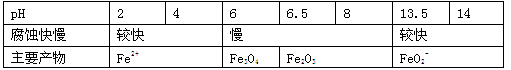
下列说法错误的是
| A.当pH<4时,碳钢主要发生析氢腐蚀 |
| B.当pH>6时,碳钢主要发生吸氧腐蚀 |
| C.当pH>14时,正极反应为O2 + 4H+ + 4e- =2H2O |
| D.将碱性溶液煮沸除去氧气后,碳钢腐蚀的速率会减缓 |
铁及其化合物在国民经济的发展中起着重要作用。
(1)已知:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1641.0 kJ·mol-1
C(石墨)+1/2O2(g)=CO(g) △H=-110.5 kJ·mol-1
则Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)的 △H= kJ·mol-1。
(2)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色(b),如图所示。液滴中心是 区(填“正极”或“负极”),其电极反应式为 。为减缓钢铁的腐蚀,可与锌块相连,该方法称为 。
(3)铁钛合金是一种不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
③ 。
把a、b、c、d 4块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时, d上产生大量气泡;a、c相连时,电流由c经导线流向a;b、d相连时,电子由d经导线流向b,则此4种金属的活动性由强到弱的顺序为
| A.a>b>c>d | B.a>c>d>b | C.c>a>b>d | D.b>a>c>d |
下列与金属腐蚀有关的说法正确的是
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,钢铁轮船外壳连接一块金属A(铜块)可以减缓船体外壳腐蚀速度 |
利用如图所示装置进行下列实验,下表中对应叙述正确的是
| A |
X为硫酸氢钠,Y为石墨 K与M连接时;K与N连接时 |
一段时间后溶液的pH均增大 |
| B |
X为氯化钠,Y为石墨 K与M连接时; K与N连接时 |
石墨电极反应均为: 4OH--4e-===2H2O+O2↑ |
| C |
X为硫酸氢钠,Y为锌 K与M连接时; K与N连接时 |
铁电极反应均为: 2H++2e-===H2↑ |
| D |
X为氯化钠,Y为锌 K与M连接时; K与N连接时 |
铁电极的保护方法均为: 牺牲阳极的阴极保护法 |
在城市中地下常埋有纵横交错的管道和输电线路,有些地面上还铺有地铁或城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道或铁轨形成回路时,就会引起后者的腐蚀。原理简化如图所示。则下列有关说法不正确的是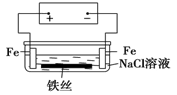
| A.原理图可理解为两个串联电解装置 |
| B.溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色 |
| C.溶液中铁丝左端电极反应式为:Fe-2e-=Fe2+ |
| D.地下管线被腐蚀,不易发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等) |
在城市中地下常埋有纵横交错的管道和输电线路,有些地面上还铺有地铁或城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道或铁轨形成回路时,就会引起后者的腐蚀。原理简化如图所示。则下列有关说法不正确的是
| A.原理图可理解为两个串联电解装置 |
| B.溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色 |
| C.溶液中铁丝左端电极反应式为:Fe-2e-=Fe2+ |
| D.地下管线被腐蚀,不易发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等) |
用图示的方法可以保护钢质闸门。下列说法正确的是
| A.当a、b间用导体连接时,则X应发生氧化反应 |
| B.当a、b间用导体连接时,则X可以是锌或石墨 |
| C.当a、b与外接电源相连时,a应连接电源的正极 |
| D.当a、b与外接电源相连时,阴极的电极反应式:2Cl--2e→Cl2↑ |
下列叙述中, 正确的是
①纯铁比碳素钢易生锈
②大量燃烧含硫燃料是形成酸雨的主要原因
③硅是光导纤维和制造太阳能电池的主要原料
④可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证元素的非金属性Cl>C>Si
⑤氯水和过氧化钠都具有漂白作用,其漂白原理相似
⑥用氢氟酸雕刻玻璃是利用氢氟酸能与二氧化硅反应的性质
⑦日本福岛核电站泄露的放射性核素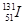 和
和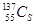 ,前者比后者少8个中子
,前者比后者少8个中子
⑧Al2O3在工业上用于制作耐高温材料,也用于电解法冶炼铝金属
| A.①⑤⑥⑦ | B.②③⑤⑦ | C.③④⑤⑥ | D.②⑤⑥⑧ |