下列电离方程式正确的是
A.H2S 2H+ + S2- 2H+ + S2- |
B.HClO = H+ +ClO- |
C.CH3COONH4 NH4+ +CH3COO- NH4+ +CH3COO- |
D.H2CO3 H+ + HCO3- H+ + HCO3- |
某化学兴趣小组在家中进行化学实验,按照左图连接好线路发现灯泡不亮,按照右图连接好线路发现灯泡亮,由此得出的结论正确的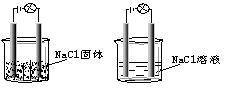
| A. NaCl是非电解质 |
| B. NaCl溶液是电解质 |
| C. NaCl在水溶液中电离出了可以自由移动的离子 |
D. NaCl溶液中水 电离出大量的离子 电离出大量的离子 |
下列物质中,其水溶液能导电,溶于水时化学键被破坏,且该物质属于非电解质的是
| A.SO2 | B.BaSO4 | C.Cl2 | D.C2H5OH |
下列叙述中,错误的是
| A.虽然固体氯化钠不能导电,但氯化钠是电解质 |
| B.纯水的pH随温度的升高而减小 |
| C.在醋酸钠溶液中加入少量氢氧化钠,溶液中c(OH—)增大 |
| D.在纯水中加入少量硫酸铵,可抑制水的电离 |
下列叙述中的前后两个量之比为1 :2的是
| A.液面在 “ 0 ” 刻度时,25mL碱式滴定管和50mL碱式滴定管所盛液体的体积 |
| B.相同温度下,0.1mol /L乙酸溶液与0.2mol /L乙酸溶液中,c(H+)之比 |
C.氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH ): c(SO ): c(SO ) ) |
| D.相同温度下,pH=12的Ba(OH)2与pH=12的KOH溶液中,c〔(Ba(OH)2〕: c(KOH) |
下列关于电解质溶液的叙述 正确的是
正确的是
A.常温下,在 的醋酸钠和醋酸混合溶液中: 的醋酸钠和醋酸混合溶液中: |
| B.稀释醋酸溶液,溶液中所有离子的浓度均降低 |
C.在 的氯化钠和稀硝酸的混合溶液中, 的氯化钠和稀硝酸的混合溶液中, |
D. 的硫化钠溶液中,• 的硫化钠溶液中,• |
下列属于电解质的一组是
①CuSO4 ②盐酸 ③水银 ④NH3 ⑤氯水 ⑥酒精 ⑦NaOH
| A.①⑦ | B.①②⑦ | C.①④⑦ | D.②③⑤⑥⑦ |
下列叙述正确的是
| A.液态HCl不导电,所以HCl是非电解质 |
| B.BaSO4难溶于水,但溶于水的部分能够全部电离,所以BaSO4是强电解质 |
| C.CH3COOH溶液的导电能力很弱,所以CH3COOH是弱电解质 |
| D.NH3的水溶液能够导电,所以NH3是电解质 |
下列哪些能说明醋酸是弱酸的事实
(1)醋酸不易腐蚀衣服
(2)0.1 mol·L-1的CH3COONa溶液的PH约为9
(3)进行中和滴定时,等体积等物质的量浓度的H2SO4溶液比等体积等物质的量浓度的CH3COOH溶液消耗的NaOH溶液多
(4)0.1 mol·L-1的CH3COOH溶液PH约为2.9
(5)相同体积的PH均等于4的盐酸和CH3COOH溶液,被同一物质的量浓度的NaOH溶液中和,CH3COOH溶液消耗的NaOH溶液多
(6)镁粉与一定量稀硫酸反应,如果向其中加入少量醋酸钠可以降低反应速率但不改变产生气体的总量
| A.(2)(4)(5)(6) | B.(2)(3)(5)(6) | C.(3)(4)(5)(6) | D.全是 |
下列对于溶液中的问题叙述正确的是
| A.向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小 |
| B.对于水的电离而言,加入强酸、强碱会促进水电离,而加入弱酸、弱碱则会抑制水电离 |
| C.5mL 0.02mol/L HCl溶液与5mL 0.02mol/L Ba(OH)2溶液混合,经充分反应后,如果溶液体积为10mL,则溶液的pH=12 |
| D.常温下,将稀NaOH溶液与CH3COOH溶液混合,可能出现pH>7,且c(OH—)>c(Na+)>c(H+)>c(CH3COO—)的情况 |
下列物质中,其水溶液能导电、溶于水时化学键被破坏,且该物质属于非电解质的是
| A.I2 | B.BaCO3 | C.CO2 | D.C6H12O6(葡萄糖) |