现有以下几种物质请用其对应的序号填空:①氧化钙 ②稀硫酸 ③二氧化硫 ④熔融的BaSO4 ⑤铜 ⑥氢氧化钠 ⑦蔗糖
(1)上述物质属于电解质的是 ;(2)属于非电解质的是 ;
(3)能导电的是 ;(4)任选一个电解质写出其电离方程式: .
下列关于混合物、纯净物、电解质和非电解质的正确组合是( )
| |
纯净物 |
混合物 |
电解质 |
非电解质 |
| A |
盐酸 |
水煤气 |
硫酸 |
干冰 |
| B |
冰醋酸 |
漂白粉 |
硫酸钡 |
二氧化硫 |
| C |
石墨 |
空气 |
苛性钾 |
碳酸钙 |
| D |
浓硫酸 |
氨水 |
氯化钠 |
氯气 |
(1)下列物质: ①Na ②Br2 ③Na2O ④NH3 ⑤CO2 ⑥蔗糖 ⑦NaCl晶体 ⑧KCl溶液 ⑨H2SO4 ⑩Ba(OH)2 ,其中属于电解质的是 ,属于非电解质的是 。 (用序号填写)
(2)从Ba(OH)2 、HCl 、Zn 、CuSO4、CaCO3中选出合适的物质,实现下列各题要求的变化,写出化学反应的离子方程式。
①实验室制取CO2的反应 。
②实验室制取H2的反应 。
③生成沉淀的反应 。
下列叙述正确的是
| A.SO2的水溶液能导电,所以SO2是电解质 |
| B.酸式盐的水溶液呈酸性 |
| C.醋酸溶液中醋酸的电离程度随温度的升高而增大 |
| D.FeCl3的溶液加热蒸干可得到FeCl3的晶体。 |
(1)写出下列物质在水溶液中的电离方程式
NaHCO3________________________Fe2(SO4)3___________________________
(2)写出下列反应的离子方程式
稀硫酸与氢氧化钡溶液混合_______________________
碳酸钙与稀盐酸混合_______________________
氧化铜与稀硫酸混合_______________________
下列方程式书写正确的是( )
| A.HCO3﹣在水溶液中的电离方程式:HCO3﹣+H2O⇌H3O++CO32﹣ |
| B.H2SO3的电离方程式:H2SO3⇌2H++SO32﹣ |
| C.CO32﹣的水解方程式:CO32﹣+2H2O⇌H2CO3+2OH﹣ |
| D.NaHCO3的电离方程式:NaHCO3═Na++H++CO32﹣ |
有以下几种物质①干燥的食盐晶体②液态氯化氢③水银④蔗糖⑤CO2⑥KNO3溶液⑦氯气,填空回答(填序号):以上物质中能导电的是 ;属于电解质的是 ;属于非电解质的是 ;
下列电离方程式书写错误的是
| A.Na2CO3 = 2Na++ CO32- | B.H2O= 2H++O2- |
| C.HNO3=H++NO3- | D.K2SO4=2K++SO42- |
【化学ーー选修2:化学与技术】
高锰酸钾( )是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为 )为原料生产高锰酸钾的工艺路线如下:
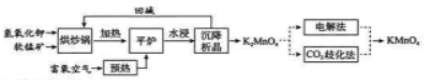
回答下列问题:
(1) 原料软锰矿与氢氧化钾按 的比例在 "烘炒锅"中混配,混配前应将软锰矿粉碎, 其作用是 。
(2) "平炉"中发生的化学方程式为 .
(3)"平炉"中需要加压,其目的是 。
(4) 将 转化为 的生产有两种工艺。
① 歧化法" 是传统工艺, 即在 溶液中通入 气体, 使体系呈中性或弱碱性,
发生歧化反应,反应中生成 和 (写化学式)。
② "电解法" 为现代工艺, 即电解 水溶液, 电解槽中阳极发生的电极反应为 , 阴极逸出的气体是_ 。
③ "电解法" 和 歧化法" 中, 的理论利用率之比为 _ 。
(5)高锰酸钾纯度的测定:称取 样品, 溶解后定容于 容量瓶中, 摇匀。取浓度为 的 标准溶液 , 加入稀硫酸酸化,用 溶液平行滴定三次, 平均消耗的体积为 , 该样品的纯度为 。
(列出计算式即可, 已知 ) 。
化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许 离子通过,氯气的逸出口是 (填标号)。
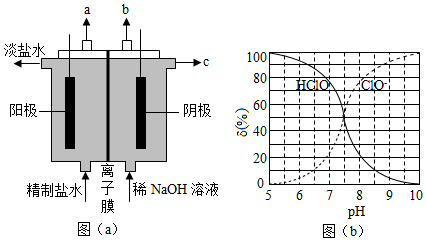
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X) ,X为HClO或ClO ﹣]与pH的关系如图(b)所示。HClO的电离常数K a值为 。
(3)Cl 2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl 2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl 2O的化学方程式为 。
(4)ClO 2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO 2、NaHSO 4、NaHCO 3的"二氧化氯泡腾片",能快速溶于水,溢出大量气泡,得到ClO 2溶液。上述过程中,生成ClO 2的反应属于歧化反应,每生成1mol ClO 2消耗NaClO 2的量为 mol;产生"气泡"的化学方程式为 。
(5)"84消毒液"的有效成分为NaClO,不可与酸性清洁剂混用的原因是 (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为 kg(保留整数)。
下列说法中正确的是
| A.氯化钠水溶液在电流的作用下电离出Na+和Cl- |
| B.二氧化碳的水溶液能够导电,故二氧化碳属于电解质 |
| C.碳酸氢钠在水中电离的离子方程式为NaHCO3=Na++H++CO2- 3 |
| D.碳酸钠属于电解质 |
下列物质能导电的是 ;属于电解质的是 ;属于非电解质的是 (填编号)。
①HCl气体、② NH3、③熔融的NaOH 、④SO2、⑤Cu 、 ⑥氨水 ⑦KNO3溶液 、⑧液态醋酸 、⑨蔗糖、⑩硫酸钡固体