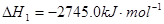有以下几种物质①干燥的食盐晶体②液态氯化氢③水银④蔗糖⑤CO2⑥KNO3溶液⑦氯气,填空回答(填序号):以上物质中能导电的是 ;属于电解质的是 ;属于非电解质的是 ;
粤ICP备20024846号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
Copyright ©2020-2024 优题课 youtike.com 版权所有
Powered by:Youtike Platform 6.6.3
声明:本网站部分内容由互联网用户自发贡献自行上传,本网站不拥有所有权,也不承担相关法律责任。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
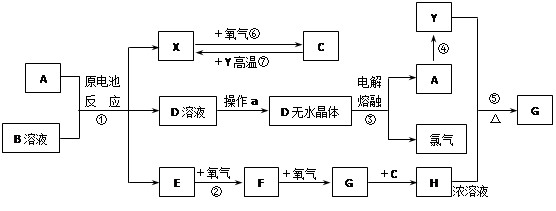
 2C(g),向容积为1L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得
2C(g),向容积为1L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得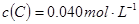 ,放出热量Q1 kJ。
,放出热量Q1 kJ。 与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A)______________K(B)(填“>”、“<”或“=”。 )
与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A)______________K(B)(填“>”、“<”或“=”。 )