如图所示装置为在直流电的作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则:
⑴a为电源的 极。
⑵写出电极反应方程式:A ,B 。
⑶如果想使反应溶液恢复到原来状态,应该加入 ,加入 g。
理论上讲,任何自发的氧化还原反应都可以设计成原电池。某同学利用 “Cu+2Ag+ =2 Ag +Cu2+ ” 反应设制一个化学电池,如图所示,已知该电池在外电路中,电流从a极流向b极。请回答下列问题: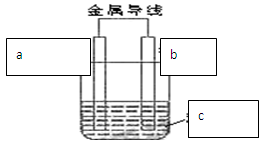
(1)b极是电池的 极,材料是 ,该极上出现的现象是 ,写出该电极的反应式 。
(2)a可能为
A、铜 B、银 C、铁 D、石墨
(3)c溶液是
A、CuSO4溶液 B、AgNO3溶液 C、酒精溶液
(4)若该反应过程中有0.2mol电子发生转移,则生成Ag为 克。
如图为相互串联的甲乙两个电解池,请回答: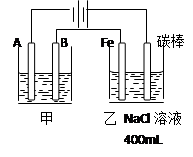
(1)若甲池为电解精炼粗铜(含有锌铁镍银金和铂等微量杂质,杂质发生的电极反应不必写出)装置,电解液选用CuSO4溶液,则:
①A电极发生的反应类型为 ; B电极和Fe电极电子的流向由 到 (填B或Fe)。
②B电极的材料是____________,电极反应式为___________ _______。
CuSO4溶液的浓度 (填 “不变”“略有增加”或“略有减少”)
(2)实验开始时,若在乙池两边电极附近同时各滴入几滴酚酞试液,则:
①写出电解NaCl溶液总的化学方程式
。
②在Fe极附近观察到的现象是____ ________。检验碳棒电极反应产物的方法是 _。
(3)若甲槽电解液为CuSO4,实验中发现阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为_____ ____L。若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为_______ ___ 。
用碳棒作电极,在Na+、Cu2+、Cl-、SO42-等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
⑴当阴极放出H2,阳极放出O2时,电解质是 ;
⑵当阴极析出金属,阳极放出O2时,电解质是 ;
⑶当阴极放出H2,阳极放出Cl2时,电解质是 ;
(4)通过电子的物质的量与阴极析出的金属的物质的量、阳极析出的气体的物质的量之比为4∶2∶1时,电解质的化学式是 。
用离子方程式表示下列化学变化:
(1)电解氯化钠溶液____________________________________________
(2)电解硝酸银溶液____________________________________________
电解原理在化学工业中有广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,
实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X电极上的电极反应是 ,
在X极附近观察到的现象是 。
②Y电极上的电极反应 ,
检验该电极反应产物的方法是 。
(2)若X和Y仍均为惰性电极,a为CuSO4溶液,则电解时的化学反应方程式为_____
_________________________。通过一段时间后,向所得溶液中加入16gCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为__________。
(3)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是___________,电极反应式是_________________________。
②Y电极的材料是___________,电极反应式是_________________________。
(说明:杂质发生的电极反应不必写出)
400 mL NaNO3和AgNO3的混合溶液中c(NO3—)=4mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到11.2L气体(标准状况),假设电解后溶液体积仍为400 mL。回答下列问题:
(1)把下列电极方程式补充完整:
阴极: 、2H+ + 2e- = H2
阳极:
(2)上述电解过程中转移电子的物质的量为 。
(3)电解后溶液中的c(H+)为
(1)以铜电极电解NaOH溶液,若产生1molH2,则消耗H2O mol。
(2)以铂电极电解饱和Na2CO3溶液,一段时间后溶液的浓度 (增大、减小或不变),有无晶体析出? (有、无)。
如图为以惰性电极进行电解:
(1)写出B、C、D各电极上的电极反应式和总反应方程式:
A:________________________________,B:________________________________,
总反应方程式:________________________。
C:________________________________, D:________________________________,
总反应方程式:___________________________。
(2)在A、B、C、D各电极上析出生成物的物质的量比为__________________。
用碳棒作电极,在H+、Na+、Cu2+、Ag+、Cl-、NO3-、SO42-等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
(1)当阴极放出H2,阳极放出O2时,电解质是 ;
(2)当阴极析出金属,阳极放出O2时,电解质是 ;
(3)当阴极放出H2,阳极放出Cl2时,电解质是 ;
(4)通过电子的物质的量与阴极析出的金属、阳极析出的气体的物质的量之比为4∶2∶1时,电解质的化学式是 。
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血
剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图(标出电极材料和电解质溶液),并写出电极反应式。
正极反应 ,
负投反应 。
(3)某同学用碳棒、铜棒和稀硫酸为原材料,以及一些必要条件,实现 Cu+H2SO4(稀)=CuSO4+H2↑反应。请在框内画出能够实现这一反应的实验装置图。
(4)另一位同学在做(3)反应实验时,看到碳棒和铜棒
上都有气泡产生,但铜棒没有被腐蚀。请你分析其原因
,
此时的总反应为 。
甲、乙两池电极材料都是铁棒与碳棒,两池中均为饱和NaCl溶液。请回答下列问题:
(1)甲池属于 (填装置名),其中正极材料为 ,其电极反应式是_____________ 。
(2)乙池属于 (填装置名),铁极上电极反应属于____________(填“氧化反应”或“还原反应”),写出乙池中总反应的离子方程式___________。
(4) 若乙池转移0.01 mol e-后停止实验,池中溶液体积是100 mL,则溶液混匀后的[OH‾]=________。(溶液体积变化忽略)
下图 为相互串联的甲乙两个电解池,请回答:
为相互串联的甲乙两个电解池,请回答: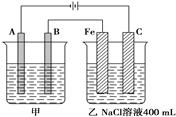
((1)甲池若为用电解原理精炼铜的装置,A极是___,材料是____,电极反应为________;B极是_________,材料是__________,主要电极反应为___________,电解质溶液为_____________。
(2)乙池中若滴入少量酚酞试液,开始一段时间后,____极附近呈红色。
(3)若甲槽阴极增重12.8 g,则乙槽阳极放出气体在标准状况下的体积为__ ______。
______。
(4)常温下若乙槽剩余液体为400 mL,则电解后得到碱液的物质的量浓度为__________。
11分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极。
接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
(1)电极b上发生的电极反应为___________________________________。
(2)电极b上生成的气体在标状况下的体积为__________________,此时甲烧杯中NaOH溶液的物质的量浓度为(设溶液的密度为1g/cm3)_______________。
(3)电极c的质量变化是___________g,欲使电解后乙中的电解液恢复到起 始状态,应该向溶液中加入适量的___________(填字母编号)。
始状态,应该向溶液中加入适量的___________(填字母编号)。
| A.Cu(OH)2 | B.Cu2O | C.CuCO3 | D. Cu2(OH)2CO3 Cu2(OH)2CO3 |
(4)其他条件不变,如果把乙装置改为电解精炼铜,则c电极的材料为___________,d电极的材料为 _____________。
(12分)
(1)以甲烷、空气、氢氧化钾溶液为原料,石墨为电极可以构成燃料电池。该电池的负极反应式为 。
(2)用如图所示装置进行电解①若A、B均为石墨电极,C为足量CuS04溶液,则电解的总反应方程式为 。
电解一段时间后,取出电极,向电解液中加入适量的 (填化学式)可使C溶液恢复到电解前的成分和浓度。
②若A、B均为铂电极,C为Na2SO4溶液(含酚酞),电解一段时间后, (填“A”或“B”)极附近显红色;将电极取出,搅拌使溶液混合均匀,测得溶液的pH 7(填“<”、“=”或“>”)。
③若A、B为同一材料的电极,C为CuCl2溶液,电解过程中CuCl2溶液的浓度始终 保持不变,则A、B为 (填化学式)电极;当电路中有0.04 mol电子通过时,阴极增重( ) g。