用脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:第一,有氧气生成;第二,____________。
过氧化钠跟水反应的化学方程式是________________________。
(2)某研究性学习小组拟用右图装置进行实验,以证明上述结论。
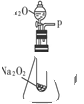
用以验证第一条结论的实验方法是:__________________。
用以验证第二条结论的实验方法及现象是:_______________________________。
(3)实验(2)中往试管内加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,发现溶液变红;振荡后,红色褪去。为探究此现象,该小组同学查阅有关资料得知:Na2O2与H2O反应可生成H2O2,H2O2具有强氧化性和漂白性。请设计一个简单的实验,证明Na2O2和足量H2O充分反应后的溶液中有H2O2存在。现有Na2S溶液、KI溶液、红色布条等,请从中选择试剂,加以验证(只要求列出实验所用的试剂及观察到的现象)。
试剂:____________。现象:______________。