浙江省台州市高二下学期六校联考化学试卷
为了建设环境友好型社会,节能减排将成为我国政府目前工作的重点,因此节约能源与建设新能源是摆在当前的一个课题。针对这一现象,某化学学习研究性小组提出如下方案,你认为不够科学合理的是
| A.采用电解水法制取氢气作为新能源 |
| B.加大开发太阳能、水能、风能、地热能等能源力度,减少化石燃料的使用 |
| C.研制推广以乙醇为燃料的汽车 |
| D.生产、生活中,努力实现资源的循环利用 |
下列说法正确的是
| A.废旧电池应集中回收,并填埋处理 |
| B.充电电池放电时,电能转变为化学能 |
| C.放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关 |
| D.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 |
反应N2+3H2 2NH3刚开始时,N2的浓度为3 mol/L,H2的浓度为5 mol/L,3 min后测得NH3浓度为0.6 mol/L,则此时间内,下列反应速率表示正确的是
2NH3刚开始时,N2的浓度为3 mol/L,H2的浓度为5 mol/L,3 min后测得NH3浓度为0.6 mol/L,则此时间内,下列反应速率表示正确的是
A.v(NH3)="0.2" mol/( L·s) L·s) |
B.v(N2)="1.0" mol/(L·min) |
| C.v(H2)="1.67" mol/(L·min) | D.v(H2)="0.3" mol/(L·min) |
下列热化学方程式书写正确的是
| A.C(s) + O2(g) ="=" CO2(g)△H= +393.5kJ/mol |
| B.2SO2 + O2 ="=" 2SO3△H=-196.6kJ/mol |
| C.H2(g) + 1/2O2(g) ="=" H2O(l)△H=-285.8kJ/mol |
| D.2H2(g) + O2(g) ="=" 2H2O(l)△H=-571.6KJ |
用石墨作电极,电解1 mol/L下列物质的溶液,溶液的pH保持不变的是
| A.HCl | B.NaOH | C.Na2SO4 | D.NaCl |
已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。关于标有“+”的接线柱,下列说法中正确的是
| A.充电时作阳极,放电时作负极 | B.充电时作阳极,放电时作正极 |
| C.充电时作阴极,放电时作负极 | D.充电时作阴极,放电时作正极 |
如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无味气体放出。符合这一情况的是表中的
| |
a极板 |
b极板 |
X电极 |
Z溶液 |
| A |
锌 |
石墨 |
负极 |
CuSO4 |
B |
石墨 |
石墨 |
负极 |
NaOH |
| C |
银 |
铁 |
正极 |
AgNO3 |
| D |
铜 |
石墨 |
负极 |
 CuCl2 CuCl2 |
已知:
(l)H2(g)+ O2(g)=H2O(g) △H1=a k
O2(g)=H2O(g) △H1=a k J·
J·
(2)2H2(g)+ O2(g)=2H2O(g) △H2=b kJ·
(3)H2(g)+ O2(
O2( g)=H2O(l) △H3=c kJ·
g)=H2O(l) △H3=c kJ·
(4)2H2(g)+ O2(g)=2H2O(l) △H4=d kJ·
下列关系式中正确的是
| A. a<c <0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
下列有关金属腐蚀与防护的说法正确的是
| A.纯银器表面在空气中主要因电化学腐蚀渐渐变暗 |
| B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
C.在海 轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,总反应式为:2C2H6+7O2+8KOH ==4K2CO3+10H2O,下列推断正确的是
| A.负极反应为7O2+14 H2O+28e— →28OH— | |
B.每消耗1molC2H6,则电路上转移的电子为14 mol |
C.放电一段时间后,负极周围的pH升高 |
| D.放电过程中KOH的物质的量浓度不变 |
现有M、N、P、E 4种元素的单质,能发生以下反应:
①在水溶液中,M+N2+===M2++N ②P+2H2O(冷)===P(OH)2+H2↑ ③N、E相连浸入稀H2SO4中,电极反应为:N-2e-===N2+,2H++2e-===H2↑ 判断它们的还原性由强到弱的顺序是
| A.M、N、P、E | B.P、M、N、E |
| C.M、N、E、P | D.E、P、M、N |
在一定条件下,对于A2(g)+3B2(g) 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
| A.v(A2)=0.8 mol·L-1·s-1 | B.v(A2)=30 mol·L-1·min-1 |
C.v(AB3)=1.0 mol ·L-1·s-1 ·L-1·s-1 |
D.v(B2)=1.2 mol·L-1·s-1 |
对于在一定条件下进行的化学反应:2SO2+O2 2SO3,改变下列条件,可以提高反应物中的活化分子百分数的是
2SO3,改变下列条件,可以提高反应物中的活化分子百分数的是
| A.升高温度 | B.增大压强 | C.压缩使容器体积变小 | D.增大反应 物浓度 物浓度 |
一定温度下的恒容容器中,能标志某可逆反应A(s)+2B(g) C(g)+D(g)已达平衡状态的是
C(g)+D(g)已达平衡状态的是
A.混合气体的压强不随时间变化而变 B.气体总物质的量不随时间变化而变化
C.2v(B)正=v(D)逆 D.混合气体的密度保持不变
对于反应:A+B=C下列条件的改变一定能使化学反应速率加快的是
| A.增加A的物质的量 | B.升高体系的温度 |
| C.减少C的物质的量浓度 | D.增大体系的压强 |
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H—O键形成时放出热量463kJ,则氢气中1mol H—H键断裂时吸收热量为
| A.920kJ | B.557kJ | C.436kJ | D.188kJ |
下列说法或表示方法正确的
A.已知C(s)+O2(g)===CO2(g)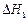 ;C(s)+ ;C(s)+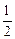 O2(g)===CO (g) O2(g)===CO (g)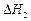 ,则 ,则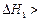 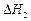 |
B.在稀溶液中,H+(aq)+OH-(aq)===H2O(l) 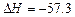 kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热大于57.3 kJ kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热大于57.3 kJ |
C.由C(石墨)===C(金刚石);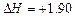 kJ·mol-1可知,金刚石比石墨稳定 kJ·mol-1可知,金刚石比石墨稳定 |
D.在101kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧的热化学方程式为:2H2(g)+O2 (g) ===2H2O(l);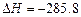 kJ·mol-1 kJ·mol-1 |
如图所示,a、b 、c、d均为石墨电极,通电一段时间后,各电极上的生成物的物质的量之比依次为4:1:2:2,则甲、乙两池中的电解质分别是
、c、d均为石墨电极,通电一段时间后,各电极上的生成物的物质的量之比依次为4:1:2:2,则甲、乙两池中的电解质分别是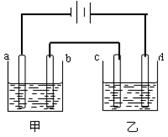
| A.AgNO3、KBr | B.CuSO4、NaNO3 |
| C.稀H2SO4、Cu(NO3)2 | D.NaOH、稀H2SO4 |
用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示。则下列说法正确的是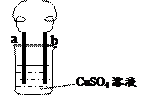
| A.构成原电池时b极反应为: Cu﹣2e-=Cu2+ |
| B.构成电解池时a极质量一定减少 |
| C.构成电解池时b 极质量可能减少也可能增加 |
| D.构成的原电池或电解池工作后就可能产生大量气体 |
用惰性电极电解一定质量的某浓度的NaCl溶液,一段时间后停止电解。此时若加入100g36.5%的浓盐酸,所得溶液正好与原溶液完全相同,则下列说法正确的是
A .电解过程中,两极所得到的气体,在相同的条件下体积相等
.电解过程中,两极所得到的气体,在相同的条件下体积相等
B.电解过程中,在相同的条件下,阳极所得到的气体的体积比阴极的大
C.原某浓度的NaCl溶液中溶有117gNaCl
D.电解过程中转移电子的物 质的量约为8mol[
质的量约为8mol[
某新型可充电电池,能长时间保持稳定的放电电压。该电池的总反应为: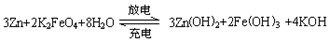 ,以下说法不正确的是:
,以下说法不正确的是:

| A.放电时负极反应为:Zn-2e–+2OH–=Zn(OH)2 |
B.放电时正极反应为: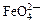 +4H2O+3e–=Fe(OH)3+5OH– +4H2O+3e–=Fe(OH)3+5OH– |
| C.充电时阳极附近溶液的碱性减弱 |
| D.放电时每转移3 mol电子,正极有1 molK2FeO4被氧化 |
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应: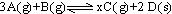 。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
| A.该条件下此反应的化学平衡常数约为0.91(L/mol)3 |
| B.A的平均反应速率为0.3mol/(L·s) |
| C.B的转化率为60% |
| D.若混合气体的密度不再改变时,该反应不一定达到平衡状态 |
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO (g )+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
)+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3=-44.0 kJ/mol
H2O(g) = H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(2)某实验小组依据甲醇燃烧的反应原理,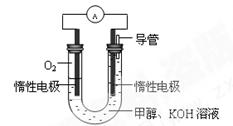
①设计如图所示的电池装置。该电池负极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为 。
用碳棒作电极,在Na+、Cu2+、Cl-、SO42-等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
⑴当阴极放出H2,阳极放出O2时,电解质是 ;
⑵当阴极析出金属,阳极放出O2时,电解质是 ;
⑶当阴极放出H2,阳极放出Cl2时,电解质是 ;
(4)通过电子的物质的量与阴极析出的金属的物质的量、阳极析出的气体的物质的量之比为4∶2∶1时,电解质的化学式是 。
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题。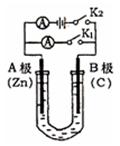
(1)打开K2 ,合并K1 ,若所盛溶液为CuSO4溶液:则A为 极,A极的电极反应式为  。若所盛溶液为KCl溶液:则B极的电极反应式为 ,K+移向 极(填A、B)
。若所盛溶液为KCl溶液:则B极的电极反应式为 ,K+移向 极(填A、B)
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则:
①A电极附近可观察到的现象是 。
②B电极的电极反应式为 。
③U形管内总反应化学方程式是 。
(3)如要用电解方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 ,电极反应式是 。B电极的材料应换成是 ,反应一段时间后电解质溶液中Cu2+浓度 (填“增大”、“减小”、“不变”)。
用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为 mol·L-1。
高炉炼铁中发生的基本反应之一如下:
FeO(固)+CO(气)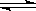 Fe(固)+CO2(气)ΔH>0
Fe(固)+CO2(气)ΔH>0
(1)则该反应中平衡常数K= 。
(2)已知1100℃时K=0.263。1100℃时测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1在这种情况下,该反应是否处于平衡状态 (选填是或否),此时化学反应速率是v正 v逆(选填>,<,=)
t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) 
 xC(g)。2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)。2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x=
(2)从反应开始至达到平衡状态,反应物A的转化率为 ;A的平均反应速率为 。
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 |
|
催化剂 |
| ① |
10ml2% H2O2溶液 |
无 |
| ② |
10mL5% H2O2溶液 |
无 |
| ③ |
10mL5% H2O2溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ④ |
10mL5% H2O2溶液+少量HCl溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ⑤ |
10mL5% H2O2溶液+少量NaOH溶液 |
1mL0.1mol·L-1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_ 。
(2)实验①和②的目的是__________________________________________。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是 。
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。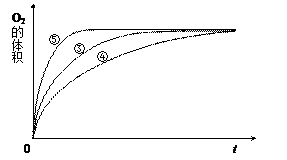
分析上图能够得出的实验结论是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号