依据下图分析,下列叙述不正确的是
| A.氯化钠是由钠离子和氯离子构成的 |
| B.氯化钠的电离方程式为:NaCl =Na+ + Cl— |
| C.氯化钠的电离过程需要通电才能完成 |
| D.氯化钠在水中形成能自由移动的水合钠离子和水合氯离子 |
右图,是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列判断正确的是( )
| A.a为负极、b为正极 |
| B.a为阳极、b为阴极 |
| C.电解过程中,d电极质量增加 |
| D.电解过程中,氯离子浓度不变 |
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下左图所示。下列说法中,正确的是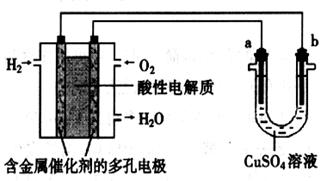
| A.若a极是铜,b极为铁时,当电池消耗1.6g O2,b极上析出6.4g铜 |
| B.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH- |
| C.若a极是粗铜,b极是纯铜时,a极减少的质量等于b极上析出铜的质量。 |
| D.若a、b两极均是石墨时,b极反应为4OH- - 4e-=O2↑+ 2H2O |
用惰性电极电解CuSO4溶液一段时间后,欲使溶液恰好恢复至电解前情况,可加入的物质是( )
| A.CuSO4 | B.Cu(OH)2 | C.Cu | D.CuO |
按图甲装置进行实验,若图乙中横坐标x表示通过电极的电子的物质的量。下列叙述正确的是( )
| A.F表示反应生成Cu的物质的量 |
| B.E表示反应实际消耗H2O的物质的量 |
| C.E表示反应生成O2的物质的量 |
| D.F表示反应生成H2SO4的物质的量 |
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
| A.a为阳极、b为阴极 | B.a为负极、b为正极 |
| C.电解过程中,氯离子浓度不变 | D.电解过程中,d电极质量增加 |
如图装置,U型管中盛有Fe(OH)3胶体,以两个碳棒为电极进行电解,一段时间后,下列叙述正确的是
| A.x是阳极,y是阴极 |
| B.x极附近颜色变深,y极近颜色变浅 |
| C.x是阴极,y极附近颜色加深 |
| D.y是阴极,x极附近颜色加深 |
下列过程需要通电才能进行的是( )
①电离 ②电镀 ③电解 ④电化学腐蚀 ⑤电泳
| A.①② | B.②③⑤ | C.②③ | D.全部 |
下列叙述正确的是
| A.在电解池的阴极和原电池的负极上都发生氧化反应 |
| B.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
| C.用惰性电极电解KOH溶液,阴、阳两极产物的物质的量之比为1:2 |
| D.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH |
下列处理方法正确的是
| A.为除去污水中的重金属离子Hg2+,向其中加入足量充分反应后过滤 |
| B.为降低能耗,工业电解熔融态的Al2O3制Al时,加入冰晶石 |
| C.为充分利用原料,氯碱工业中,将阳极室的饱和氯化钠溶液电解为水后导出 |
| D.为保护公路两旁的铁护栏,将其与电源的负极相连 |
下图中滤纸Ⅰ上浸有饱和食盐水和酚酞,滤纸Ⅱ上浸有KMnO4溶液,接通电源一段时间后,发现a点附近变红,则下列说法中正确的是
| A.a点和电源正极相连 |
| B.发生还原反应 |
| C.c点附近pH减小 |
| D.d点附近颜色加深 |
右图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是( )
| A.从E口逸出的气体是H2 |
| B.从B口加入含少量NaOH的水溶液以增强导电性 |
| C.标准状况下每生成22.4 LCl2,便产生2 mol NaOH |
| D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加Na2CO3溶液 |
以惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1mol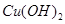 ,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为:
,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为:
| A.0.1mol | B.0.2mol | C.0.3mol | D.0.4mol |
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应作
| A.阴极 | B.阳极 | C.正极 | D.负极 |