下列叙述正确的是
| A.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图一所示,石墨电极上产生氢气,铜电极发生氧化反应 |
| B.图一所示当有0.1mol电子转移时,有0.1molCu2O生成 |
| C.图二装置中发生:Cu+2Fe3+ = Cu2++2Fe2+,X极是负极,Y极材料可以是铜 |
| D.如图二,盐桥的作用是传递电荷以维持电荷平衡,Fe3+经过盐桥进入左侧烧杯中 |
【改编】下面是常见的电化学装置图,①②④中均为惰性电极,下列说法错误的是

| A.装置①中电解一段时间后,要恢复原溶液,应加入一定量的水。 |
| B.装置②中b极为正极,该极的电极反应方程式为O2+4H++ 4e-=2H2O |
| C.装置③中铜片为阳极,若铜片和铁制品的质量相等,电解一段时间后,电路中有2mol电子转移,此时铜片和铁制品的质量差为128g |
| D.装置④中阳极每产生标况下11.2L Cl2,则阳离子交换膜上透过1mol Na+ |
某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。

实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
| 物质 |
氯化铜 |
氧化亚铜 |
氢氧化亚铜(不稳定) |
氯化亚铜 |
| 颜色 |
固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 |
红色 |
橙黄色 |
白色 |
*相同温度下CuCl的溶解度大于CuOH
下列说法错误的是
A.反应结束后最终溶液呈碱性
B.阴极上发生的电极反应为:2H2O + 2e-¯ ═ H2↑+ 2OH-¯
C.电解过程中氯离子移向阳极
D.试管底部红色的固体具有还原性
用酸性氢氧燃料电池电解苦卤水(含Cl—、Br—、Na+、Mg2+)的装置如下图所示(a、b为石墨电极),下列说法正确的是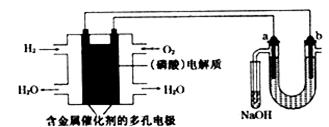
| A.电池工作时,正极反应式为O2+2H2O+4e-=4OH- |
| B.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| C.试管中NaOH溶液是用来吸收电解时产生的Cl2 |
| D.当电池中消耗2.24L(标准状况)H2时,b极周围会产生0.02mol气体 |
CuI是一种不溶于水的白色固体,它可由反应2Cu2++4I-=2CuI+I2而得到。现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液。电解开始不久阴极区溶液呈红色,而阳极区溶液呈蓝色,对这些现象的正确解释是
①阴极2H++2e-= H2↑,使c(OH-)>c(H+)
②阳极4OH--4e-=2H2O+O2↑,O2将I-氧化为I2,I2遇淀粉变蓝
③阳极2I--2e-=I2,I2遇淀粉变蓝
④阳极2Cu-4e-+4I-=2CuI+I2,I2遇淀粉变蓝
| A.①② | B.①③ | C.①④ | D.③④ |
以惰性电极电解CuSO4和NaCl的混合溶液,两电极上产生的气体(标准状况下测定)体积如下图所示,下列有关说法正确的是
| A.a表示阴极上产生的气体,t1前产生的为Cl2 |
| B.原溶液中CuSO4和NaCl物质的量之比为1:1 |
| C.若t2时溶液的体积为1 L,此时溶液的pH为13 |
| D.若原溶液体积为1 L,则原溶液中SO42-的物质的量浓度为0.2 mol/L |
Ⅰ.已知在常温常压下:
① 2CH3OH(l)十3O2(g)=2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol—1
② H2O(l)=H2O(g) △H="+" 44.0 kJ.mo—1
写出表示甲醇燃烧热的热化学方程式 。
Ⅱ.磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图:

(1)在Na3PO4溶液中,c(Na+)/c(PO43-) 3(填“>”“=”“<”),向Na3PO4溶液中滴入稀盐酸后 ,pH从10降低到5的过程中发生的主要反应的离子方程式为 。
(2)从图中推断NaH2PO4溶液中各种微粒浓度大小关系正确的是 。(填选项字母)
A、C(Na+)> C(H2PO4 -)> C(H+)> C(HPO4 2-)> C(H3PO4 )
B、C(Na+)> C(H2PO4 -)> C(OH-)> C( H3PO4)> C(HPO4 2- )
C、C(H+)+ C(Na+)=C(OH-)+C(H2PO4-)+2C(HPO42-)+3C(PO43-)+C(H3PO4 )
D、C(Na+)=C(H2PO4-)+C(HPO42-)+C(PO43-)+C(H3PO4 )
(3)假设25℃条件下测得0.1 mol·L–1的Na3PO4溶液的pH=12 ,近似计算出Na3PO4的第一步水解的水解常数Kh(写出计算过程,忽略Na3PO4的第二、第三步水解,结果保留两位有效数字)。
Ⅲ.化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染。电化学降解NO3-的原理如图所示。电源正极为 (填A或B),阴极反应式为 。
取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是( )
| A.b电极是阴极 | B.a电极与电源的正极相连 |
| C.电解过程中水是氧化剂 | D.b电极附近溶液的pH变小 |