用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )

| A.用石墨作阳极,铁作阴极 |
| B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O |
| C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH- |
| D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O |
某研究性学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、C、E是铁电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。下列说法不正确的是 ( )

A、电源B 极的名称是负极
B、甲装置中电解反应的总化学方程式是: CuSO4+Fe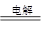 Cu+ FeSO4
Cu+ FeSO4
C、设电解质溶液过量,则同一时内C、D电极上参加反应的单质或生成的单质的物质的量之比是1:1
D、设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为0.2mol/L
利用如图装置,完成很多电化学实验。下列有关此装置的叙述中,正确的是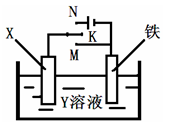
| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓锌的腐蚀,这种方法称为牺牲阴极保护法。 |
| B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀。 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动。 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小。 |
观察下列几个装置示意图,有关叙述正确的是
| A.装置①中阳极上析出红色固体 |
| B.装置②的待镀铁制品应与电源正极相连 |
| C.装置③闭合电键后,外电路电子由a极流向b极 |
| D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过 |
电解法是处理工业废水的一种重要方法。如酸性含(Cr2O72-)废水就可以采用电解法进行无害化处理。电解时采用Fe作阳极,惰性电极作阴极。已知:①氧化性:Cr2O72->Fe3+;②Cr2O72-被还原生成Cr3+;③Ksp[Cr (OH)3]=6.3×10-31。下列说法正确的是
| A.阳极材料也可以是Cu |
| B.阴极每产生3molH2,则有1mol Cr2O72-被还原 |
| C.一段时间后溶液中发生反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O |
| D.电解最后阶段需要加碱,使溶液中的阳离子转化为沉淀 |
碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
| A.VB2电极发生的电极反应为:2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+ |
| B.外电路中电子由c电极流向VB2电极 |
| C.电解过程中,c电极表面先有红色物质析出,后有气泡产生 |
| D.若B装置内的液体体积为100 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |
用下图所示装置除去含、
废水中的
时,控制溶液
为9~10,阳极产生的
将
氧化为两种无污染的气体,下列说法不正确的是

| A. | 用石墨作阳极,铁作阴极 |
| B. |
阳极的电极反应式为:
|
| C. |
阴极的电极反应式为:
|
| D. |
除去
|
电渗析法是指在外加电场作用下,利用阴离子交换膜和阳离子交换膜的选择透过性,使部分离子透过离子交换膜而迁移到另一部分水中,从而使一部分水淡化而另一部分水浓缩的过程。下图是利用电渗析法从海水中获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO等离子,电极为石墨电极。
下列有关描述错误的是
| A.阳离子交换膜是A,不是B |
| B.通电后阳极区的电极反应式:2Cl--2e-=Cl2↑ |
| C.工业上阴极使用铁丝网代替石墨碳棒,增大反应接触面 |
| D.阴极区的现象是电极上产生无色气体,溶液中出现少量白色沉淀 |
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.图为RFC工作原理示意图,有关说法正确的是
A. 当有0.1mol电子转移时,a极产生1.12L O2(标准状况下)
B. b极上发生的电极反应是:4H2O+4e﹣=2H2↑+4OH﹣
C. d极上发生的电极反应是:O2+4H++4e﹣=2H2O
D. c极上进行还原反应,B中的H+可以通过隔膜进入A
乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示。该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法不正确的是
| A.N电极上的电极反应式:HOOC-COOH+2e-+2H+=HOOC-CHO+H2O |
| B.若有2 mol H+ 通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1 mol |
| C.M电极上的电极反应式为:2Cl--2e-=Cl2↑ |
| D.乙二醛与M电极的产物反应生成乙醛酸的化学方程式: Cl2+OHC-CHO+ H2O = HOOC-CHO+2HCl |
下图中甲池是以甲醇为原料,KOH为电解质的高效燃料电池,电化学过程的如图。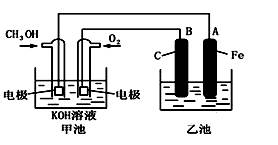
下列说法中不正确的是
| A.甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O |
| B.若乙池中为足量AgNO3溶液,则阳极的电极反应为: 4OH--4e- = 2H2O+O2↑ |
| C.若乙池中为一定量CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移的电子数为0.2NA |
| D.常温常压下,1 g CH3OH燃料生成CO2和液态H2O时放热22.68 kJ,表示该反应的热化学方程式为:CH3OH(l)+1.5O2(g)==CO2(g)+2H2O(l) ΔH=" -725.76" kJ·mol-1 |
有一硝酸盐晶体,其化学式为R(NO3)x·yH2O,相对分子质量为242。 取1.21 g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.01mol电子发生转移时,溶液中金属全部析出。经称量阴极增重0.32g。下列叙述正确的是
| A.x=3 |
| B.金属R的相对原子质量为56 |
| C.y=2 |
| D.电解后溶液的pH=1(电解过程中溶液体积变化忽略不计) |
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
电池:Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O(l)
电解池:2Al + 3H2O = Al2O3 + 3H2↑
对该电解过程,以下判断正确的是
| |
电 池 |
电 解 池 |
| A |
H+ 移向Pb电极 |
H+ 移向Pb电极 |
| B |
每消耗3mol Pb |
生成1mol Al2O3 |
| C |
正极:PbO2+4H++2e-=Pb2++2H2O |
阳极:2Al+3H2O-6e-=Al2O3+6H+ |
| D |
Pb电极反应质量不变 |
Pb电极反应质量不变 |
【改编】用酸性氢氧燃料电池电解硫酸钠饱和溶液的装置如图所示(a、b为铜电极)。下列说法中不正确的是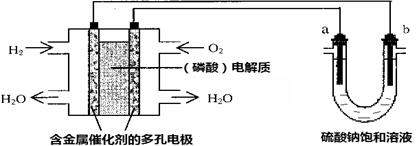
| A.电池工作时,正极反应式为:O2 + 4H++ 4e-= 2H2O |
B.电解时,当阴极逸出a mol气体,同时有W克Na2SO4•10H2O 析出,保持温度不变,剩余溶液中的硫酸钠的质量分数是 |
| C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| D.忽略能量损耗,当电池中消耗0.01g O2 时,b 极周围会产生0.02g H2 |