在铜-锌-稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是
①锌片溶解32.5 g ②锌片增重32.5 g ③铜片上析 出1g H2 ④铜片上析出1 mol H2
| A.①和③ | B.①和④ | C.②和③ | D.②和④ |
将AsO +2I—+2H+
+2I—+2H+  AsO
AsO +I2+H2O设计成右下图所示的电化学装置,其中C1、C2均为碳棒。甲、乙两组同学分别进行下述操作(盐桥能能让离子通过):
+I2+H2O设计成右下图所示的电化学装置,其中C1、C2均为碳棒。甲、乙两组同学分别进行下述操作(盐桥能能让离子通过):
甲组:向B烧杯中逐滴浓盐酸;
乙组:向B烧杯中逐滴加入40%NaOH溶液
下列描述中,正确的是 ( )
| A.甲组操作过程中,C2做负极 |
| B.乙组操作过程中,C1上发生的电极反应为: 2I—-2e—=I2 |
| C.两次操作过程中,微安表(G)指针的偏转方向相反 |
| D.甲组操作时该装置为原电池,乙组操作时该装置为电解池 |
如右图所示的铜锌原电池中,铜电极为
| A.负极 | B.正极 |
| C.发生还原反应的一极 | |
| D.发生氧化反应的一极 |
根据下列实验现象,所得结论正确的是
A B C D
| 实验 |
实验现象 |
结论 |
| A |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
| B |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
| C |
白色固体先变为淡黄色,后变为黑色 |
溶解性:AgCl>AgBr>Ag2S |
| D |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:Cl>C>Si |
根据右图所示的装置(甲中电极均为惰性电极)判断下列叙述中正确的是 ( )
| A.甲是一种具有应用前景的绿色电源 |
| B.甲中b电极的电极反应为:40H-一4e=2H20+02↑ |
C.通电初期乙中的总反应为:Cu + H2SO4 |
| D.反应过程中甲、乙装置的pH都逐渐减小 |
镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列说法不正确的是
| A.电池总反应为:Mg+H2O2=Mg(OH)2 |
| B.正极发生的电极反应为:H2O2+2H++2e-=2H2O |
| C.工作时,正极周围海水的pH增大 |
| D.电池工作时,溶液中的H+向负极移动 |
某研究小组用NaOH溶液吸收二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如图,则下列有关说法错误的是
| A.阳极区酸性增强 |
| B.阴极区电极反应式为:2H++2e—=H2↑ |
| C.diluent和concentrated的中文含义为浓缩的、稀释的 |
| D.该过程中的副产品主要为H2SO4 |
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是
| A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3 |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O |
| C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
| D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是 ( )
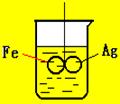
| A.铁圈和银圈左右摇摆不定; | B.保持平衡状态; |
| C.铁圈向下倾斜; | D.银圈向下倾斜; |
4.
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该项燃料电池说法正确的是 ( )
| A.在熔融电解质中,O2-移向正极 | B.电池总反应式是:2C4H10+13O2→8CO2+10H2O |
| C.通入空气的一极是正极,电极反应为:O2+4e-=2O2- | |
| D.通入丁烷的一极是正极,电极反应为:C4H10+26e-+13O2-==4CO2+5H2O |
发生原电池的反应通常是放热反应,在理论上可设计成原电池的是: ( )
| A.C(s)+H2O(g)="CO(g)+" H2(g);△H>0 |
| B.Ba(OH)2.8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3.H2O (1) +8H2O(1);△H>0 |
| C.CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H<0 |
| D.CH4(g)+2O2(g)→CO2(g) +2H2O(1);△H<0 |
锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时电极反应式为负极反应:C6Li-xe-==C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料)正极反应:Li1-xMO2+xLi++xe-==LiMO2(LiMO2表示含锂的过渡金属氧化物)下列有关说法正确的是
| A.锂离子电池充电时电池反应为C6Li+Li1-xMO2==LiMO2+C6Li1-x |
| B.电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量最小 |
| C.锂离子电池放电时电池内部Li+向负极移动 |
| D.锂离子电池充电时阴极反应为C6Li1-x+xLi++x e-==C6Li |
将氢气、甲烷、乙醇等物质在氧气中燃烧时的化学能直接转化为电能的装置叫燃料电池。燃料电池的基本组成为电极、电解质、燃料和氧化剂。此种电池能量利用率可高达80%(一般柴油发电机只有40%左右),产物污染也少。下列有关燃料电池的说法错误的是
| A.上述燃料电池的负极反应材料是氢气、甲烷、乙醇等物质 |
| B.氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理之后可供宇航员使用 |
| C.乙醇燃料电池的电解质常用KOH,该电池的负极反应为:C2H5OH-12e-=2CO2↑+3H2O |
| D.甲烷燃料电池的正极反应为O2+2H2O+4e-=4OH- |