下列说法正确的是
| A.铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连 |
B.向氨水中不断通入CO2,随着CO2的增加, 不断增大 不断增大 |
| C.3C(s)+ CaO(s)=CaC2(s)+ CO(g)在常温下不能自发进行,说明该反应的△H>0 |
| D.合成氨时,其他条件不变,升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
下列说法不正确的是
| A |
B |
C |
D |
| 通电一段时间后, 搅拌均匀,溶液的 pH增大 |
甲电极上的电极反应为: 2Cl--2e-= Cl2↑ |
Pt电极上的电极反应为: O2+2H2O+4e-==4OH- |
总反应的离子方程式 为:2Fe3++Cu=Cu2++ 2Fe2+ |
 |
 |
 |
 |
如图所示装置,均盛有等体积等浓度的稀硫酸,工作相同的时间后测得均通过n mol e-。下列叙述错误的是(不考虑溶液体积的变化)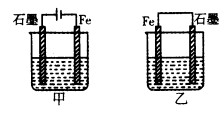
| A.铁棒的腐蚀程度:甲<乙 |
| B.碳电极上发生反应的电极反应式相同 |
| C.溶液的pH:甲减小,乙增大 |
| D.甲乙产生气体的体积(相同条件)比为3:2 |
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是
| A.正极反应中有CO2生成 |
| B.微生物促进了反应中电子的转移 |
| C.质子通过交换膜从负极区移向正极区 |
| D.电池总反应为C6H12O6+6O2=6CO2+6H2O |
某同学为研究电化学原理,使用KC1盐桥设计如图所示实验装置。下列分析不合理的是
| A.闭合K2断开K1,左侧烧杯中的Fe2+向铁电极移动 |
| B.无论闭合K1断开K2,还是断开K1闭合K2,石墨电极上发生的反应都是Fe3++e-= Fe2+ |
| C.闭合K1断开K2,电流从石墨电极经过K1流向铁电极 |
| D.闭合K1断开K2,左侧烧杯中的溶液pH将逐渐降低 |
关于下列装置的说法正确的是
| A.装置①中盐桥内的K+移向CuSO4溶液 |
| B.装置①将电能转变为化学能 |
| C.若装置②用于铁棒镀铜,则N极为铁棒 |
| D.若装置②用于电解精炼铜,溶液中的Cu2+浓度保持不变 |
有A、B、C、D四种金属,已知:D投入水中可与水剧烈反应;用A和C作电极,稀硫酸作电解质溶液构成原电池时,C为正极;B和C的离子共存于电解液中,以石墨为电极电解时阴极析出B。则这四种金属的活动性由强到弱的顺序是
A.C >D> B >A B.B> D > C > A C.D > A > C> B D.D> C> A> B
某学习小组用实验验证牺牲阳极的阴极保护法装置如右图所示,下列说法正确的是: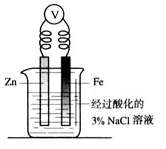
| A.实验过程会观察到电压表指针有偏转,是产生气流所致; |
| B.Zn电极作为负极,发生还原反应; |
| C.向烧杯中滴入铁氰化钾后,铁电极附近出现蓝色沉淀; |
| D.实验过程加入氯化钠是增大电解质溶液的离子浓度以加快反应速率。 |
下列有关物质的性质和应用对应正确的是( )
| A.炭在常温下化学性质不活泼,因此在埋木桩前,可将埋入地下的一段表面用火微微烧焦 |
| B.碳酸钠的水溶液呈碱性,医学上能用于治疗胃酸过多 |
| C.盐酸与苛性钠可自发进行反应,该反应可以设计成原电池 |
| D.次氯酸具有强氧化性,可以起到除去水中悬浮的杂质和杀菌消毒作用 |
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示(质子交换膜只允许H+通过)。下列有关微生物电池的说法错误的是
| A.正极反应中有CO2生成 |
| B.微生物促进了反应中电子的转移 |
| C.质子通过交换膜从负极区移向正极区 |
| D.电池总反应为C6H12O6+6O2=6CO2+6H2O |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
| A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-= +4H2O +4H2O |
| C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |
铅酸蓄电池是目前应用普遍的化学电池,新型液流式铅酸蓄电池以可溶性的甲基磺酸铅为电解质,电池总反应为:Pb+PbO2+4H+ 2Pb2++2H2O。下列有关新型液流式铅酸蓄电池的说法正确的是
2Pb2++2H2O。下列有关新型液流式铅酸蓄电池的说法正确的是
| A.放电时负极反应式为Pb-2e﹣+SO42﹣=PbSO4 |
| B.充放电时,溶液的导电能力变化不大 |
| C.以该电池电解NaCl溶液时,当消耗207gPb时,在阳极生成Cl222.4L |
| D.充电时的阳极反应式为Pb 2++2e-+4OH﹣=PbO2+2H2O |
一种微生物燃料电池工作原理示意图如下,微生物膜中的酶作催化剂。下列叙述不正确的是
| A.电池工作时,既能净化废水,又能发电 |
| B.X电极为负极,工作时发生氧化反应 |
| C.正极反应式为2NO3-+10e-+6H2O =N2↑+12OH- |
| D.该电池在常温和高温时都可以工作 |
利用如图装置探究铁在海水中的电化学腐蚀与防护。下列说法不正确的是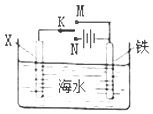
| A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀,采用了牺牲阳极的阴极保护法 |
| B.若X为锌棒,开关K置于N处,X极的反应:4OH--4e-=O2↑+2H2O |
| C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀,采用了外加电流的阴极保护法 |
| D.若X为碳棒,开关K置于M处,X极的反应:O2+4e-+2H2O=4OH- |
下图所示装置的叙述,正确的是
| A.铜是阳极,铜片上有气泡产生 |
| B.盐桥中的阳离子会移向CuSO4溶液 |
| C.正极附近的SO42-离子浓度逐渐增大 |
| D.锌离子在锌片表面被还原 |