原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是
| A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+ |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O |
| C.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
| D.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
下列化学反应在理论上可设计成原电池是
| A.2Al(s) + 2NaOH(aq) +2H2O(l) ="=" 2NaAlO2(aq) + 3H2(g) △H<0 |
| B.HNO3(aq) + KOH(aq) ="=" KNO3(aq) + H2O(l) △H<0 |
| C.Ba(OH)2·8H2O(s) + 2NH4Cl(s) ="=" BaCl2(aq)+ 2NH3·H2O(aq)+ 8H2O(l) △H﹥0 |
| D.Na2O(s)+ H2O(l) ="=" 2NaOH(aq) △H<0 |
用下图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升。下列说法正确的是( )

| A.同温、同压下,装置Ⅰ中石墨电极上方得到的气体比铁电极上方得到的气体多 |
| B.用装置Ⅱ进行实验时铁电极的电极反应为Fe-2e-+2OH-= Fe(OH)2 |
| C.用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-= H2↑ |
| D.装置Ⅰ通电10分钟后铁电极周围溶液pH降低 |
关于如图所示装置的叙述,正确的是
| A.铜是阳极,铜片上有气泡产生 |
| B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 |
| D.铜离子在铜片表面被还原 |
右图为一原电池的结构示意图,下列说法中,错误的是
| A.Cu电极为正电极 |
| B.原电池工作时,电子从Zn电极流出 |
| C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu |
| D.盐桥(琼脂-饱和KCl溶液)中的K+移向ZnSO4溶液 |
如图所示的装置中,M为活动性顺序位于氢之前的金属,N为石墨棒,关于此装置的下列叙述中,不正确的是( )

| A.N上有气体放出 |
| B.M为负极,N为正极 |
| C.是化学能转变为电能的装置 |
| D.导线中有电流通过,电流方向是由M到N |
据报道,我国拥有完全自主产权的氢氧燃料电池车已在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关该电池的叙述不正确的是
| A.正极反应式为:O2+2H2O+4e-=4OH- |
| B.工作一段时间后,电解液中KOH的物质的量不变 |
| C.该燃料电池的总反应方程式为:2H2+O2=2H2O |
| D.该电池工作时每消耗1 mol O2,有2 mol电子转移 |
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应:2Fe+2H2O+O2 =2Fe2++4OH-。以下说法正确的是
| A.负极发生的反应为:Fe-2e-=Fe2+ |
| B.正极发生的反应为:2H2O+O2+2e-=4OH- |
| C.原电池是将电能转变为化学能的装置 |
| D.钢柱在水下部分比在空气与水交界处更容易腐蚀 |
关于下图所示的原电池,下列说法正确的是
| A.电子沿着盐桥从锌电极流向铜电极 |
| B.盐桥中的阳离子向硫酸铜溶液中迁移 |
| C.电流从锌电极通过电流计流向铜电极 |
| D.铜电极上发生的电极反应是2H++2e-===H2↑ |
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料 的电池装置如图所示,该电池以空气中的氧气为氧化剂,以 KOH 溶液为电解质溶液.下列关于该电池的叙述错误的是( )
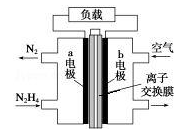
| A.b 极发生还原反应 | |
B.a 极的反应式为 N2H4﹣4e﹣═N2↑+4H+ |
C.放电时,电流从 b 极经过负载流向 a 极 |
| D.其中的离子交换膜需选用阴离子交换膜 |
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极.X、Y、Z三种金属的活动性顺序为
| A.X>Y>Z | B.X>Z>Y | C.Y>X>Z | D.Y>Z>X |
某原电池结构如右图所示,下列有关该原电池的说法正确的是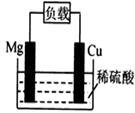
| A.电池反应为:Mg+2H+=Mg2++H2↑ |
| B.镁棒发生还原反应 |
| C.电子从铜棒经外电路流向镁棒 |
| D.铜棒为负极 |
下列说法正确的是( )

| A.图a中,随着电解的进行,溶液中c(H+)增大 |
| B.图b中,Mg电极做电池负极 |
| C.图c中,发生的反应为Co+Cd2+=Cd+Co2+ |
| D.图d中,K分别与M、N连接,Fe电极均受到保护 |
下列说法正确的是
| A.铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连 |
B.向氨水中不断通入CO2,随着CO2的增加, 不断增大 不断增大 |
| C.3C(s)+ CaO(s)=CaC2(s)+ CO(g)在常温下不能自发进行,说明该反应的△H>0 |
| D.合成氨时,其他条件不变,升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |