下列可设计成原电池的化学反应是
| A.H2O (l)+CaO(s) =Ca(OH)2(s) |
| B.Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3·H2O+8H2O |
C.2KClO3 2KCl+3O2↑ 2KCl+3O2↑ |
D.CH4(g)+2O2(g)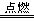 CO2(g)+2H2O(l) CO2(g)+2H2O(l) |
下列有关电能特点的说法错误的是
| A.电能是现代社会应用最广泛,使用最方便,污染最小的二次能源; |
| B.目前我国发电总量中火电所占比率最多; |
| C.燃煤发电过程中能量转换方式为:化学能→热能→机械能→电能; |
| D.火力发电过程中能量转化率很高。 |
关于如图所示的原电池,下列说法正确的是
| A.电子从铜电极通过检流计流向锌电极 |
| B.盐桥中的阳离子向硫酸铜溶液中迁移 |
| C.锌电极发生还原反应,铜电极发生氧化反应 |
| D.铜电极上发生的电极反应是2H++2e-===H2↑ |
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 |
| D.产生气泡的速度甲比乙慢 |
依据原电池原理,设计番茄电池并检测电流的产生,其中合理的是
A.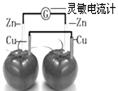 |
B.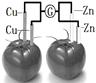 |
C. |
D. |
在下图所示的柠檬电池中,外电路上的电子从电极Y流向电极X。若X为铁,则Y可能是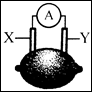
| A.锌 | B.石墨 | C.银 | D.铜 |
【改编】下列说法中,不正确的是
| A.反应热指的是反应过程中放出或吸收的热量 |
| B.原电池的正极发生氧化反应 |
| C.化学变化一定伴随能量变化 |
| D.升温反应速率一定加快 |
下图为番茄电池,下列说法正确的是
| A.一段时间后,锌片质量会变小 |
| B.铜电极附近会出现蓝色 |
| C.电子由铜通过导线流向锌 |
| D.锌电极是该电池的正极 |
某原电池的总反应为:Cu + 2Fe3+ = Cu2+ + 2Fe2+
| |
A |
B |
C |
D |
| 电极材料 |
Cu、Zn |
Cu、Ag |
Fe、Zn |
Cu、C |
| 插入溶液 |
FeCl3 |
Fe(NO3) 2 |
CuSO4 |
Fe2(SO4)3 |
下列说法正确的是
| A.铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| B.一个化学反应是吸热还是放热,取决于反应物和生成物总能量的相对大小 |
| C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
| D.在原电池的负极和电解池的阴极上都发生失电子的氧化反应 |
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是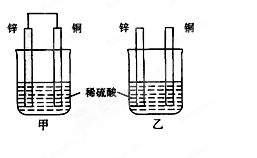
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 |
| D.产生气泡的速度甲比乙慢 |
下图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是

下列叙述的原因不是由于原电池造成的是
| A.运输液氯的铁管被腐蚀 | B.金属在潮湿空气中更容易腐蚀 |
| C.铁与酸反应滴加硫酸铜后反应加快 | D.含杂质的锌比纯锌与酸反应快 |