上海市十三校高三第二次联考化学试卷
化学与社会、生产、生活密切相关。下列说法正确的是
| A.65%的酒精用于消毒 | B.Al(OH)3可用于治疗胃酸过多 |
| C.明矾用于水的杀菌消毒 | D.从海水中提取可燃冰 |
化学学科需要借助化学专用语言描述,下列有关化学用语正确的是
A.CO2分子比例模型: |
B.NH4I的电子式: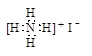 |
| C.乙醇的结构简式:C2H5OH |
| D.K+最外层电子排布式:4S24P6 |
下列关于化石燃料的说法正确的是
| A.石油分馏可获得石油气、汽油、苯及其同系物等 |
| B.石油催化裂化主要得到乙烯、乙炔等 |
| C.煤含有苯和甲苯,可干馏后获得苯和甲苯 |
| D.煤的液化、气化属于均属于化学变化 |
捕碳技术是指从空气中捕获CO2的技术。目前NH3已经被用作工业捕碳剂。下列物质中不能作为捕碳剂的是
A.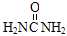 |
B.H2NCH2CH2NH2 | C.(NH4)2CO3 | D.Na2CO3 |
化学家借助太阳能产生的电能和热能,用空气和水作原料成功地合成了氨气。下列有关说法正确的是
| A.该合成中所有的电能和热能全部转化为化学能 |
| B.该合成氨过程不属于氮的固定 |
| C.空气、水、太阳能均为可再生资源 |
| D.断裂N2中的N≡N键会释放出能量 |
氮化钠(Na3N)晶体熔融时能导电。下列描述正确的是
| A.构成晶体的两种微粒电子层结构相同 |
| B.构成晶体的两种微粒半径相等 |
| C.构成晶体的两种微粒的核外电子能量相同 |
| D.构成晶体的两种微粒的电子层数不同 |
描述硅原子核外电子运动说法错误的是
| A.有4种不同的伸展方向 | B.有14种不同运动状态的电子 |
| C.有5种不同能量的电子 | D.有5种不同的运动范围 |
工业上制备下列金属,采用的化学反应原理正确的是
A.镁:2MgO (熔融)  Mg+O2↑ Mg+O2↑ |
B.钙:CaO+C Ca+CO↑ Ca+CO↑ |
C.锰:3MnO2+4Al 3Mn+2Al2O3 3Mn+2Al2O3 |
D.汞:HgS Hg+S Hg+S |
短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示。下列说法正确的是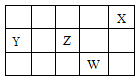
| A.原子半径的大小顺序: r(W) >r(Z)> r(Y) |
| B.Y、Z的氢化物有可能含非极性键 |
| C.Z、W形成的化合物W显负价 |
| D.Y分别与Z、W形成的化合物全部都是非极性分子 |
下列有关钠的叙述中,错误的是
| A.钠的还原性很强,可以用来冶炼金属钛、锆、铌等 |
| B.钠的化学性质非常活泼,钠元素只能以化合态存在于自然界 |
| C.钠极易和水反应而被还原 |
| D.钠、氧化钠、氢氧化钠的焰色反应均显黄色 |
下列离子方程式中正确的是
A.向硫酸铜溶液中加入过量的NaHS溶液:Cu2++2HS- CuS↓+H2S↑ CuS↓+H2S↑ |
B.Fe3O4溶解在过量的稀硝酸中:Fe3O4+8H+ Fe2++2Fe3++4H2O Fe2++2Fe3++4H2O |
C.碳酸氢铵溶液与苛性钾溶液混和共热:NH4++OH- NH3↑+H2O NH3↑+H2O |
D.将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O SO32-+2HClO SO32-+2HClO |
交警对驾驶员是否饮酒进行检测用酒精分析器,其原理是酒精与CrO3反应生成蓝绿色的Cr3+。根据颜色变化能判断是否饮过酒及饮酒量的多少。下列对乙醇性质的描述与此测定原理无关的是
| A.沸点低 | B.密度比水小 | C.溶于水 | D.具有还原性 |
物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂。下列关于物质X的说法正确的是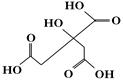
| A.X分子式为C6H6O7 |
| B.1 mol物质X可以和3 mol氢气发生加成 |
| C.X分子不可以发生消除反应 |
| D.足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体物质的量相同 |
工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气、和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
(1)4FeO·Cr2O3 + 8Na2CO3 + 7O2 8Na2CrO4 + 2Fe2O3 + 8CO2
8Na2CrO4 + 2Fe2O3 + 8CO2
(2)2Na2CrO4 + H2SO4→Na2SO4 + Na2Cr2O7 + H2O
下列说法正确的是
| A.反应(1)和(2)均为氧化还原反应 |
| B.反应(1)的氧化剂是O2,还原剂是FeO·Cr2O3 |
| C.高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4 |
| D.反应(1)中每生成1molNa2CrO4时电子转移3mol |
下列实验现象描述正确的是
| A.电解氯化铜溶液,将阳极气体产物通入碘化钾淀粉溶液中,溶液变蓝 |
| B.红热的铜丝在氯气中燃烧,产生了棕黄色的雾 |
| C.碘水中加入少量裂化汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色 |
| D.向含有苯酚的苯溶液中滴入少量浓溴水,产生了白色沉淀 |
足量铜溶于一定量浓硝酸,产生NO2、N2O4、NO的混合气体,这些气体若与1.12LO2(标准状况)混合后通入水中,气体被水完全吸收。若向原所得溶液中加入5 mol·L-1H2SO4溶液100 mL,则继续溶解的Cu的质量为
| A.6.4g | B.9.6g | C.19.2g | D.24g |
为了除去FeSO4溶液中的Fe3+,可用加入纯铁屑,但此法很费时;现有一种方法是在蒸馏水沸腾时加入粉未状的绿矾(少量多次),搅拌,直到观察到有褐色沉淀产生即可停止加入药品,煮沸1~2分钟,趁热过滤,密封保存所得的FeSO4溶液,此法的原理是
| A.Fe3+易水解,它的水解产物之一能抑制的Fe2+ 水解 |
| B.Fe2+ 有较强的还原性,它能还原Fe3+ |
| C.Fe3+有较强的氧化性,它能氧化Fe2+ |
| D.Fe3+的水解是吸热反应,升温能促进它的水解 |
常温下向盛水烧杯中加2g生石灰(如下图)。搅拌后再恢复到原温,在此过程中,下列说法正确的是
| A.水的电离常数不变 |
| B.Ca(OH)2的电离程度先大后变小然最后不变 |
| C.水的电离平衡向逆反应方向移动最后不变 |
| D.水的电离度将会先变小然后变大最后不变 |
对某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝
③加入数滴氯水时,溶液无色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在溶液中是否存在的是
| A.Br- | B.SO42- | C.H2SO3 | D.NH4+ |
将0.5 mol·L-1的Na2CO3溶液与amol·L-1的NaHCO3溶液等体积混合,所得溶液中粒子浓度间的关系及相关判断正确的是
| A.c(Na+)>2c(CO32-)+c(HCO3-)+c(OH-) |
| B.c(Na+)>c(CO32-)+c(HCO3-)+c(H2CO3) |
| C.若c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),则可确定a>0.5 |
| D.若c(CO32-)+2c(OH-) = 2c(H+)+c(HCO3-)+3c (H2CO3), 则可确定a=0.5 |
下列各项表述与示意图一致的是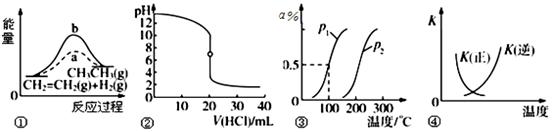
| A.图①中a、b曲线分别表示反应CH2=CH2(g)+H2(g) →CH3CH3(g) +ΔQ ,0<ΔQ;使用和未使用催化剂时,反应过程中的能量变化 |
| B.图②表示25 ℃时,用0.01 mol·L-1盐酸滴定一定体积的0.01 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
C.图③表示CH4(g)+H2O(g) CO(g)+3H2(g) +ΔQ ,反应CH4的转化率与温度、压强的关系,且p1>p2、0<ΔQ CO(g)+3H2(g) +ΔQ ,反应CH4的转化率与温度、压强的关系,且p1>p2、0<ΔQ |
D.图④中曲线表示反应2SO2(g)+O2(g)  2SO3(g) +ΔQ ,0<ΔQ;正、逆反应的平衡常数K随温度的变化 2SO3(g) +ΔQ ,0<ΔQ;正、逆反应的平衡常数K随温度的变化 |
肼(N2H4)又称联氨,其液体可燃,燃烧热较大且燃烧产物对环境无污染,可以用作火箭燃料。肼溶于水是一种二元碱。
完成下列填空:
(1)写出肼的电子式 ,肼的晶体类型 。
(2)工业上可用次氯酸钠和氨反应制肼,若只有一种氧化产物。写出该方法制备肼的化学方程式 。
(3)0.2mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出128.3kJ的热量。
写出该反应的热化学方程式 。
(4)室温下,N2H5Cl的水溶液显 (填酸、碱、中)性。
其原因是。
已知:H2O 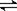 H + + OH- Kw = 1×10-14
H + + OH- Kw = 1×10-14
N2H4 + H2O 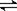 [N2H5]+ + OH- K1 = 8.5×10-7
[N2H5]+ + OH- K1 = 8.5×10-7
[N2H5]+ + H2O 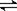 [N2H6]2++ OH- K2 = 8.4×10-15
[N2H6]2++ OH- K2 = 8.4×10-15
(5)肼可以和氧气反应N2H4+O2→N2+2H2O。为除去高压锅炉用水中溶解的O2,常用N2H4或Na2SO3。除去等物质的量的O2,所消耗的N2H4和Na2SO3的质量之比为 。
与N2H4相比较,使用Na2SO3会对锅炉造成不良的影响,其原因是 。
烟气的脱硫(除SO2)和脱硝(除NOx)都是环境科学研究的热点。可以通过氧化还原反应或酸碱反应进行脱硫和脱硝。完成下列填空:
(1)烟气中含有一定量的氮氧化物(NOx),可以利用甲烷与NOx一定条件下反应,产物为空气中含有的无害成分,从而消除污染。
写出CH4与NOx反应的化学方程式 。
(2)用催化剂可以使NO、CO污染同时降低,2NO(g)+2CO (g) N2(g)+2CO2(g),根据传感器记录某温度下NO、CO的反应进程,测量所得数据绘制出下图。
N2(g)+2CO2(g),根据传感器记录某温度下NO、CO的反应进程,测量所得数据绘制出下图。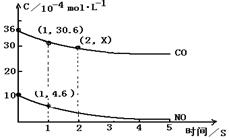
前1s内平均反应速率v(N2)
第2s时的X值范围 。
(3)为了除去烟气有害气体SO2并变废为宝,常用熟石灰的悬浊液洗涤废气,反应最终产物为石膏。而不采用澄清石灰水或熟石灰固体替代熟石灰悬浊液来吸收废气。
说明理由:
(4)用标准浓度的酸性KMnO4溶液可以测定空气中SO2含量。写出此测定方法的离子方程式 。
(5)双碱法是一种低成本高效率的脱硫方法。先用第一碱作为吸收剂,与含SO2的烟气在吸收塔中接触发生反应,烟气中的SO2被吸收掉,然后脱硫废液在另一反应器中再与第二碱反应,使溶液得到再生,再生后的吸收液循环利用。
可用作第一碱 。可用作第二碱 。(选填编号)
a.NaOH b.Mg(OH)2 c.石灰石 d.石灰
(本题共12分)工业烧碱成分NaOH、Na2CO3和可溶于水但不与酸反应的杂质,工业纯碱成分Na2CO3、NaHCO3和可溶于水但不与酸碱反应的杂质。为测定碱中各成分的百分含量可采用滴定法、气体法等。
完成下列填空:
(1)滴定法测定工业烧碱样品:配制250mL待测液,所用的主要仪器有烧杯、量筒、胶头滴管、玻璃棒、 。
(2)测定工业烧碱的总碱量n Na2O(或总耗酸量):进行滴定时,先向盛待测液的锥形瓶中加 作为指示剂。
判断滴定终点的现象是 。
(3)气体法测定工业烧碱的Na2CO3含量(如图):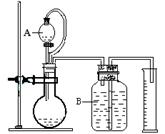
装置中B部分盛放的试液是 。
装置中A部分的分液漏斗与烧瓶之间连接的导管所起的作用是 。
(4)用中和滴定的氯化钡法测定工业烧碱中NaOH的含量时,可先在混合液中滴加过量的BaCl2溶液,再以酚酞作指示剂,然后用标准盐酸滴定。
滴加过量的BaCl2溶液目的是 。
向混有碳酸钡沉淀的氢氧化钠溶液中滴入盐酸,为什么不会使碳酸钡溶解而能测定氢氧化钠的含量 。
(5)用中和滴定的氯化钡法测定工业纯碱中NaHCO3的含量时,使用与测定烧碱相同的实验操作,过程稍作改变即可。
简述该操作过程 。
(本题共12分)乙酸正丁酯常用作香精,实验室用冰醋酸和正丁醇制备乙酸正丁酯
Ⅰ.乙酸正丁酯粗产品的制备
试管中加少许入沸石、7.4 mL正丁醇和6.4 mL冰醋酸,再加入3~4滴浓硫酸,然后安装好装置,加热使之反应。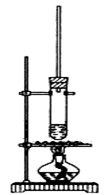
Ⅱ.乙酸正丁酯粗产品的精制
将试管中的液体转移到分液漏斗中,用10 mL水洗涤,除去下层水层;有机层继续用10 mL 10% Na2CO3洗涤至中性;再用10 mL 的水洗涤。
将酯层进行蒸馏。蒸馏收集乙酸正丁酯产品时,应将温度控制在126.1℃左右。
Ⅲ.计算产率
称量出制得的乙酸正丁酯的质量为5. 12 g。
已知:
| 物质 |
密度/g·cm-3 |
沸点/℃ |
溶解度/100g水 |
| 正丁醇 |
0.810 |
118.0 |
9 |
| 冰醋酸 |
1.049 |
118.1 |
互溶 |
| 乙酸正丁酯 |
0.882 |
126.1 |
0.7 |
完成下列填空: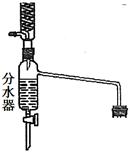
(1)上图装置中长导管有冷凝回流作用,它可以由分水回流装置代替。分水回流装置中回流下来的蒸气冷凝液进入分水器,待分层后,有机层会自动流回到反应器中,将生成的水从分水器中放出去。
分水回流代替长导管回流,对乙酸正丁酯的合成有什么作用 。
使用分水器装置进行回流的可逆反应,一般应具备 条件。
(2)分水器在使用时须预先加水,使其水面低于分水器回流支管下沿3~5 mm的水。
预先加水的目的是 。
(3)反应时加热有利于 提高酯的产率,但温度过高时酯的产率反而降低,
其可能的原因是 。
(4)水洗的目的是 。碱洗的目的是 。
测pH值的操作 。
(5)本次实验乙酸正丁酯的产率 。
(本题共9分)乙烯在不同的条件下可被氧化生成不同产物。如下图所示:
已知:取0.62g A与过量的金属钠完全作用后,生成224mL(标准状况)气体。B的沸点低(10.7℃),B不能发生银镜反应而C能。D有酸性、强氧化性,可用于消毒杀菌。
完成下列填空:
(1)写出结构简式A D
(2)写出C发生银镜反应的化学方程式 。
(3)在C的溶液中加入溴水实验现象:
解释产生该实验现象可能原因:
(4)D可以和乙烯反应产生B,写出该反应的化学方程式 。
(本题共13分)药物M主要用于防治骨质疏松症和乳腺癌,其结构式为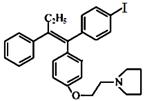 (不考虑立体结构)。
(不考虑立体结构)。
M的新旧二条合成路线如下:
旧路线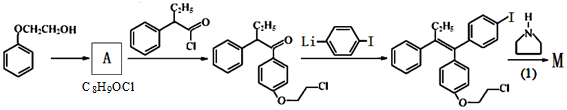
新路线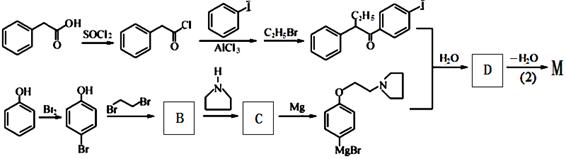
已知:(1)半缩醛可水解: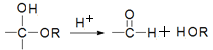
(2)卤代烃(RX)与镁于室温下在干燥乙醚中反应,生成格氏试剂(RMgX):RX+Mg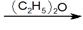 RMgX
RMgX
格氏试剂很活泼,能与许多物质发生反应。如: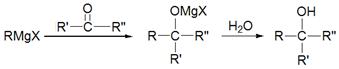
完成下列填空:
(1)写出反应类型。 (1) (2)
(2)写出结构简式。 A D
(3)旧法中的原料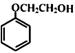 有多种同分异构体,其中满足①遇FeCl3显色②苯环上的一溴取代物只有一种,符合条件的同分异构体数目有 种。
有多种同分异构体,其中满足①遇FeCl3显色②苯环上的一溴取代物只有一种,符合条件的同分异构体数目有 种。
任写其中一种的结构简式 。
(4)写出B→C反应的化学方程式 。
(5)设计一条以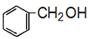 及含二个碳原子的有机化合物为原料,制备芳香醇
及含二个碳原子的有机化合物为原料,制备芳香醇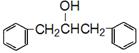 的合成路线 (不超过5步反应)。
的合成路线 (不超过5步反应)。
(本题共14分)铜有多种化合物,氧化亚铜(Cu2O)、氯化亚铜(CuCl)、氯化铜(CuCl2)、CuSO4等。
完成下列计算:
(1)波尔多液是由硫酸铜、生石灰和水配制成的杀菌剂,不同情况下需要配制不同的比例。现配制按质量比CuSO4:CaO:H2O =1:2:200的波尔多液50Kg。
需要用CuSO4·5H2O g,CaO mol
(2)某工厂以精辉铜矿(主要成分为Cu2S)为原料冶炼金属铜,精辉铜矿中含23%杂质,日均产含Cu量97.5%的粗铜42t。
已知:总反应式 Cu2S+O2 2Cu+SO2
2Cu+SO2
日均需精辉铜矿 t,日均产SO2标准状况下体积 L
(3)印刷线路板的铜能被FeCl3的溶液腐蚀,将印刷线路板浸入200mL FeCl3溶液中,有11.2gCu被腐蚀掉。取出印刷线路板,向溶液中加入11.2g铁粉,充分反应溶液中还有4.8g不溶物。计算原FeCl3溶液的物质的量浓度。
(4)制备铜的某化合物晶体。取5.12g Cu、14.5mol/L HNO3 15 mL、6.0 mol/L HC1 50mL,混合后Cu完全反应,反应后溶液有中水54.32g,再经水浴保温蒸发掉42g水,冷却至20℃并过滤,得到8.12g晶体。通过计算推断此晶体的化学式 。
已知:20℃溶解度 CuC12·2H2O 73g /100g H2O Cu(NO3)2·3H2O 125g /100g H2O


 粤公网安备 44130202000953号
粤公网安备 44130202000953号