在右图所示的原电池中,下列说法正确的是( )

A.正极反应为 Cu - 2e-  Cu2+ Cu2+ |
| B.溶液中H+向锌片移动 |
| C.电子由锌片通过导线流向铜 |
| D.该装置能将电能转化为化学能 |
镁电池毒性低、污染小,电压高而平稳,它逐渐成为人们研制绿色电池的关注焦点。其中一种镁电池的反应原理为:

下列说法正确的是( )
| A.放电时,Mo3S4发生氧化反应 |
| B.放电时,负极反应式:Mo3S4+2xe-→Mo3S42x- |
| C.充电时,Mg2+向阴极迁移 |
| D.充电时,阳极反应式:xMg2++2xe-→xMg |
对于原电池的电极名称,叙述错误的是( )
| A.发生氧化反应的一极为负极 | B.正极为电子流入的一极 |
| C.比较不活泼的金属为负极 | D.电流流出的一极为正极 |
将反应IO3-+5I-+6H+ 3I2+3H2O设计成如下图所示的原电池,甲、乙烧杯中都加入淀粉溶液。开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转。下列判断不正确的是( )
3I2+3H2O设计成如下图所示的原电池,甲、乙烧杯中都加入淀粉溶液。开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转。下列判断不正确的是( )

| A.两次电流计指针偏转方向相反,电流计读数为零时,反应达到化学平衡状态 |
| B.两次实验中,盐桥中的阳离子移动方向相反 |
| C.开始加入少量浓硫酸时,只有乙烧杯中溶液变蓝。 |
| D.向甲烧杯中滴入几滴浓NaOH溶液后,乙中石墨电极上发生还原反应 |
锌铜原电池产生电流时,阳离子( )。
| A.移向Zn极,阴离子移向Cu极 | B.移向Cu极,阴离子移向Zn极 |
| C.和阴离子都移向Zn极 | D.和阴离子都移向Cu极 |
如下图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
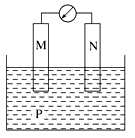
| |
M |
N |
P |
| A |
Zn |
Cu |
稀硫酸溶液 |
| B |
Cu |
Fe |
稀盐酸溶液 |
| C |
Ag |
Zn |
硝酸银溶液 |
| D |
Zn |
Fe |
硝酸铁溶液 |
某同学做完Zn-Cu-H2SO4组成的原电池的实验后,在读书卡片上作了如下记录,其中合理的是( )
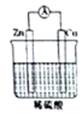

| A.①②③ | B.④⑤⑥ | C.③④⑤ | D.②③⑥ |
有关如下图所示原电池(盐桥中装有含琼胶的KCl饱和溶液)的叙述,正确的是
| A.铜棒上有气泡逸出 |
| B.取出盐桥后,电流计依然发生偏转 |
| C.反应中,盐桥中的K+会移向CuSO4溶液 |
| D.反应前后铜棒质量不改变 |
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2=2Fe2++4OH-。以下说法正确的是
| A.负极发生的反应为:Fe-2e-==Fe2+ |
| B.正极发生的反应为:2H2O+O2+2e-==4OH- |
| C.原电池是将电能转变为化学能的装置 |
| D.钢柱在水下部分比在空气与水交界处更容易腐蚀 |
关于铅蓄电池的说法正确的是( )
| A.在放电时,正极发生的反应是Pb(s)+SO42-(aq)=PbSO4(s)+2e- |
| B.在放电时,该电池的负极材料是铅板 |
| C.在充电时,电池中硫酸的浓度不断变小 |
| D.在充电时,阳极发生的反应是 PbSO4(s)+2e-=Pb(s)+SO42-(aq) |
被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内是离子“流过”水和氧化锌组成的电解液。电池总反应为:
Zn + 2 MnO2十H2O =" ZnO" + 2MnO(OH)。下列说法正确的是
| A.该电池的正极为锌 |
| B.该电池反应中二氧化锰起催化剂作用 |
| C.当 0.lmol Zn 完全溶解时,流经电解液的电子个数为 1.204×l023 |
| D.电池正极反应式为: 2MnO2 + 2e一+ 2H2O =" 2MnO" (OH)十2OH- |
有关电化学知识的描述正确的是
| A.理论上说,任何能自发进行的氧化还原反应都可设计成原电池 |
| B.某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥内可以是含琼脂的KCl饱和溶液 |
| C.因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中组成原电池,铁作负极,铜作正极,其负极反应式为Fe-2e-===Fe2+ |
| D.由Al、Mg与氢氧化钠溶液组成的原电池,其负极反应式为Mg-2e-+2OH-===Mg(OH)2 |
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是Ni(OH)2 + M =" NiOOH" + MH
已知:6NiOOH + NH3 + H2O + OH-="6" Ni(OH)2 + NO2- 下列说法正确的是
| A.电池放电过程中,正极电极反应式为:NiOOH + H2O + e-= Ni(OH)2 + OH- |
| B.充电过程中阴极的电极反应式:H2O + M + e-="MH" + OH-,H2O中的H被M还原 |
| C.充电过程中OH-离子从阳极向阴极迁移 |
| D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 |