下列说法正确的是
| A.在一定温度下的AgCl水溶液中,Ag+和Cl-浓度的乘积一定是个常数 |
| B.AgCl的Ksp=1.8×10-10 mol2·L-2,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2·L-2 |
| C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液 |
| D.向饱和AgCl水溶液中加入少量盐酸,Ksp值变大 |
下列说法不正确的是( )
| A.Ksp只与难溶电解质的性质和温度有关 |
| B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C.其他条件不变,离子浓度改变时,Ksp不变 |
| D.两种难溶电解质作比较时,Ksp小的,溶解度一定小 |
已知氧化性:HClO>Cl2>Fe3+>SO42-;常温下,电离常数:K(H2CO3)>K(HClO)>K(HCO3-)>K[Al(OH)3];则下列相关离子方程式正确的是
| A.0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合: HSO3-+ClO-=SO42-+Cl-+H+ |
| B.小苏打溶液与偏铝酸钠溶液混合:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32- |
| C.“84”消毒液(主要成分为NaClO)露置在空气中变质: 2ClO-+CO2+H2O=CO32-+2HClO |
| D.在“84”消毒液中滴加FeSO4溶液:2Fe2++ClO-+H2O=2Fe3++Cl-+2OH- |
在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),若使固体Mg(OH)2的量减少,而且c(Mg2+)不变,可采取的措施是
Mg2+(aq)+2OH-(aq),若使固体Mg(OH)2的量减少,而且c(Mg2+)不变,可采取的措施是
| A.加MgCl2 | B.加H2O | C.加NaOH | D.加HCl |
已知AgCl的溶解度为1.5×10-4g , AgBr的溶解度为8.4×10-6g ,如果将AgCl和 AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生反应的结果为
| A.只有AgBr沉淀生成 | B.AgCl和AgBr沉淀等量生成 |
| C.AgCl沉淀多于AgBr沉淀 | D.AgCl沉淀少于AgBr沉淀 |
Na2FeO4是一种高效的水处理剂,下列用于解释事实的方程式中,不正确的是
| A.Na2FeO4消毒、杀菌时得到的Fe3+可以净水,Fe3+能产生净水物质的原因是: Fe3++3H2O  Fe(OH)3(胶体)+3H+ Fe(OH)3(胶体)+3H+ |
| B.工业上可用FeCl3、NaOH、NaClO三种物质反应制得Na2FeO4,化学方程式为: 2FeCl3+10NaOH+3NaClO ="==" 2 Na2FeO4+9NaCl+5H2O |
| C.Na2FeO4在酸性溶液中不稳定,与水反应生成Fe3+和O2,离子方程式为: 4FeO42-+10H2O ="==" 4Fe3++20OH-+3O2↑ |
| D.工业上可用铁做阳极,电解浓NaOH溶液的方法制Na2FeO4,阳极的电极反应为: |
Fe-6e-+8OH-="==" FeO42-+4H2O
溴酸银(AgBrO3)的溶解度随温度变化曲线如右上图所示,下列说法正确的是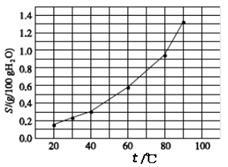
| A.温度升高不利于溴酸银的溶解 |
| B.溴酸银的溶解是放热过程 |
| C.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |
| D.60 ℃时,将0.04g溴酸银加入到10g水中,形成的分散系中存在沉淀溶解平衡 |
25℃,两种酸的电离常数如下表。
| |
Ka1 |
Ka2 |
| H2A |
1.3×10-2 |
6.3×10-6 |
| H2B |
4.2×10-7 |
5.6×10-7 |
下列叙述中正确的是
A.H2A的电离方程式:H2A=2H++A2-
B.常温下,在水中Na2B的水解平衡常数为: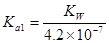
C.等浓度的Na2A和Na2B溶液,由水电离产生的H+浓度大小关系为:前者大于后者
D.向Na2B溶液中加入少量H2A溶液,可发生反应:B2-+H2A=A2-+H2B
某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )

提示:BaSO4(s) Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
| A.加入Na2SO4可以使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
常温下,对于醋酸溶液的下列说法中,不正确的是
| A.0.1 mol·L-1的醋酸溶液中加水稀释,溶液中c(OH-)减小 |
| B.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| C.pH=4的醋酸溶液与pH=10的烧碱溶液等体积混合后溶液呈酸性 |
| D.醋酸溶液中加入少量醋酸钾晶体,醋酸电离程度减小 |
下列有关说法正确的是
A.25℃时,pH=5盐酸和pH=9的氨水,两溶液中水的电离程度不同
B.25℃时,Ksp(A)> Ksp(B),说明化合物A的溶解度比化合物B的大
C.常温下pH=4的盐酸中:c(H+)=c(OH-)+c(Cl-)
D.在NH4Cl溶液中加入适量硫酸,可使c(NH4+):c(Cl-)接近1:1
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010 mol/L,向该溶液中逐滴加入0.010 mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 ( )
| A.Cl-、Br-、CrO42- | B.CrO42-、Br、Cl- |
| C.Br-、Cl-、CrO42- | D.Br、CrO42-、Cl- |
室温下,往0.1mol/L的氨水中滴入酚酞试液时,溶液将呈现粉红色。现采取下列措施,滴有酚酞的氨水溶液颜色不会变浅的是
| A.往溶液中滴入稀硫酸 | B.往溶液中加入NH4Cl晶体 |
| C.把溶液加热至沸腾 | D.往溶液中加入NaOH固体 |
在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法中不正确的是
| A.T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等 |
| B.向饱和Ag2CrO4溶液中加入固体K2CrO4不能使溶液 由Y点变为X点 |
| C.T ℃时,Ag2CrO4的Ksp为1×10-8 |
D.图中a=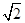 ×10-4 ×10-4 |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
(2)CuSO4+Na2S: Cu2++S2-=CuS↓
下列几种物质的溶解度大小的比较中,正确的是
| A.CuS<Cu(OH)2<CuCO3 | B.CuCO3<Cu(OH)2<CuS |
| C.CuS<CuCO3<Cu(OH)2 | D.Cu(OH)2<CuCO3<CuS |