CaCO3是一种难溶物质,其Ksp=2.8×10-9 , 先将等体积的Na2CO3溶液与CaCl2溶液混合,若Na2CO3溶液的浓度为2×10-4mol·L-1,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为多少?(写出计算过程)
已知25℃时,Ksp(Mg(OH)2)=1.8×10-11,Ksp(Cu(OH)2)=2.2×10-20。请按要求回答下列问题:
(1)在25℃下,向浓度均为0.1 mol・L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成____________沉淀(填化学式),生成该沉淀的离子方程式为________________。
(2)25℃时,向0.01 mol・L-1的MgCl2溶液中,逐滴加入浓NaOH溶液,当Mg2+完全沉淀时,溶液的pH为_______________(忽略溶液体积变化,已知lg1.8=0.26)。
(3)已知25℃时,Ksp(Fe(OH)3)=2.79×10-39,试求该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K,写出计算推理过程。
Fe3++3H2O的平衡常数K,写出计算推理过程。
已知常温下,BaSO4的Ksp为1×10-10。现将0.01 mol/L Ba(OH)2溶液与0.02 mol/L的Na2SO4溶液等体积混合,充分反应。计算:
(1)混合溶液中Ba2+物质的量浓度;
(2)混合溶液的pH值。
水垢中可能含有CaCO3、MgCO3、Mg(OH)2,某学生为了测定水垢的组成,做了如下实验:
(1)取2.90g水垢样品,加入40mL盐酸,为保证固体全部溶解,并使二氧化碳全部逸出,盐酸的物质的量浓度≥_____________mol/L;
(2)另取2.89g水垢高温灼烧至恒重,残余固体为CaO和MgO,其质量为1.48g,产生的气体被足量的澄清石灰水吸收,得到0.03molCaCO3沉淀,则原水垢中一定含有MgCO3,理由是___________________;
通过计算确定是否含有Mg(OH)2?
(3)水垢中CaCO3的质量分数?
碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:
(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是 。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是 。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式: 。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值(写出计算过程)。涉及反应如下(均未配平):
NiOOH+Fe2++H+—Ni2++Fe3++H2O Fe2++MnO4-+H+—Fe3++Mn2++H2O
(12分)某科研小组在900℃的空气中合成出化学式为La2Ca2MnOx的超导体材料,其中La以+3价存在。为确定x的值,进行如下分析:
步骤1:准确称取0.5250g超导体材料样品,放入锥形瓶中,加25.00mL0.06000mol•L-1Na2C2O4溶液(过量)和25mL6mol•L-1HNO3溶液,在60-70℃下充分摇动,约半小时后得到无色透明溶液A(该条件下,只有Mn元素被还原为Mn2+,Na2C2O4被氧化为CO2)。
步骤2:用0.02000mol•L-1KMnO4溶液滴定溶液A至终点,消耗10.00mL KMnO4溶液。
(1)步骤1反应后溶液中Mn2+的物质的量浓度为0.02000mol•L-1。常温下,为防止Mn2+形成Mn(OH)2沉淀,溶液的pH的范围为 [已知Mn(OH)2的Ksp=2.0×10-13]
(2)步骤2滴定终点的现象是 。
(3)步骤2滴定终点读数时俯视刻度,其他操作都正确,则所测x的值将 (填“偏大”、“偏小”或“不变”)。
(4)求x的值(写出计算过程)。
在20mL 0.0025mol·L-1 AgNO3溶液中,加入5mL 0.01mol·L-1 KCl溶液,通过计算判断是否有AgCl沉淀生成。已知Ksp(AgCl)=1.8×10-10 (混合后溶液的总体积为两者体积之和)。
某温度下,将50mL 0.2mol/L MgCl2溶液与50mL 0.2 mol/LNaOH溶液充分混合。
已知此温度下KSP[Mg(OH) 2]=1.8 10
10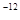
(1)通过计算,判断混合后是否有沉淀生成。(要求写出计算过程)
(2)求最终溶液中的OH–的物质的量浓度。
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题。
(1)汽车尾气的大量排放是造成空气污染的重要因素之一,发展燃料电池汽车可以有效地解决上述问题。直接甲醇燃料电池(DMFC)不会产生有害产物,能量转换效率比内燃机要高2~3倍,电池结构如图所示,c处通入的物质为为______,外电路中电子从______到______(填“A”或“B”)移动,写出电池负极的电极反应方程式 
(2)工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是处理铬污染的常用方法。该法用Fe做电极电解含Cr2O72-的酸性废水,电解时,在阴极上有大量气泡生成,并产生Cr(OH)3、Fe(0H)3沉淀。
①反应中,1molCr2O72-完全生成Cr(OH)3沉淀,外电路通过电子的物质的量为_________ mol。
②常温下,Cr(OH)3的溶度积 ,当Cr3+浓度小于10
,当Cr3+浓度小于10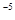 mol
mol 时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。
时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。
(3)含氨废水易引发水体富营养化。向NH4Cl溶液中加入少量NaOH固体,溶液中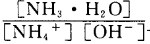 ________(填“增大”“减小”或“不变”);25
________(填“增大”“减小”或“不变”);25 时,NH3•H2O的电离平衡常数
时,NH3•H2O的电离平衡常数 ,该温度下,1mol
,该温度下,1mol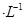 的NH4Cl溶液中
的NH4Cl溶液中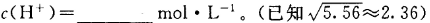
已知在室温时,Mg(OH)2的溶度积Ksp=5.6×10-12 (mol/L)3,要使0.2mol/lMgSO4溶液中的Mg2+沉淀较为完全[c(Mg2+)<5.6×10-6mol/L],则应向溶液中加入NaOH溶液,使溶液的pH最小为多少?
已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3。
(1)在铜盐溶液中Cu2+发生水解反应的离子方程式为____,该反应的平衡常数为____;(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3/L3)
(2)根据H3PO3的性质可推测Na2HPO3稀溶液的pH______7(填“>”“<”或“=”)。常温下,向10mL0.01mol/L H3PO3溶液中滴加10ml0.02mol/LNaOH溶液后,溶液中各种离子浓度由大到小的顺序是_________;
(3)电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
①阳极的电极反应式为____________________。
②产品室中反应的离子方程式为____________。
铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(―)工业废水中含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是 。
(2)阴极附近溶液pH升高的原因是_ (用电极反应式解释);溶液中同时生成的沉淀还有 。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在400℃以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下:
已知①某赤铁矿石含60.0%Fe2O3、3.6%FeO,还含有Al2O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:
(3)步骤②中加双氧水的目的是 ,pH控制在3.4的作用是 ,已知25℃时,Ksp[Cu(OH)2] =2.0 10-20,该温度下反应:Cu2++2H2O
10-20,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K= 。
Cu(OH)2+2H+的平衡常数K= 。
(4)如何判断步骤③中沉淀是否洗涤干净? 。
(5)制备氮化铁磁粉的反应:Fe+NH3 FexNy+H2 (未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为 。
FexNy+H2 (未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为 。
铜及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS)。写出CuSO4转变为铜蓝的离子方程式_______________________________。
(2)工业上以黄铜矿CuFeS2)为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
(3)图I是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图II是粗铜精炼的装置图,假若用燃料电池为电源进行粗铜的精炼实验。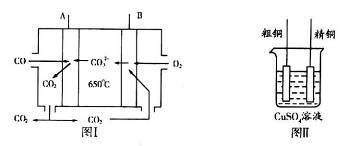
①写出A极的电极反应式__________________________________________________。
②要用燃料电池为电源进行粗铜的精炼实验,粗铜板应与__________极(填“A”或“B”)相连;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为___________。
③当消耗标准状况下1.12LCO时,精铜电极的质量变化情况为_________。
(4)现向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,根据该实验可得出的结论是________(填序号)
| A.Ksp(CuCO3)<Ksp(CaCO3) | B.c(Cu2+)<c(Ca2+) |
C.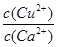 > >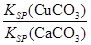 |
D.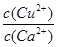 < <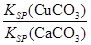 |
摩尔盐[xFeSO4·y(NH4)2SO4·zH2O]是一种重要化工原料。其组成可通过下列实验测定:
①称取1.5680 g样品,准确配成100 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.4660 g。
③再量取25.00 mL溶液A,滴加适量稀硫酸,用0.0200 mol·L-1KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00 mL。
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1. 0×10-5mol·L-1,应保持溶液中c(Ba2+)
≥ mol·L-1。
(2)③中发生反应的离子方程式为 ,滴定终点的现象是 。
(3)通过计算确定样品的组成(必须写出计算过程)。
化学能与电能之间的相互转化与人的生活实际密切相关,在生产、生活中有重要的应用,同时也是学生形成化学学科素养的重要组成部分。
(1)熔融状态下,钠的单质和氯化亚铁能组成可充电电池(如图1),反应原理为:2Na+FeCl2  Fe+2NaCl,该电池放电时,正极反应式为 ________________ _____:
Fe+2NaCl,该电池放电时,正极反应式为 ________________ _____:
充电时,__________(写物质名称)电极接电源的负极;
该电池的电解质为________ _。
(2)某同学用铜片、石墨作电极电解一定浓度的硫酸铜溶液(如图2),一段时间停止通电取出电极。若在电解后的溶液中加入0.98g氢氧化铜粉末恰好完全溶解,经测定所得溶液与电解前完全相同。请回答下列问题: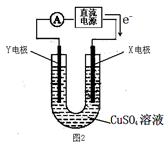
①Y电极材料是 ,发生 (填“氧化或还原”)反应。
②电解过程中X电极上发生的电极反方应式是:
③如在电解后的溶液中加入足量的小苏打,充分反应后产生气体在标准状况下所占的体积是
(3)常温时,BaSO4的Ksp=1.08×10-10,现将等体积的BaCl2溶液与2.0×10-3mol/l的Na2SO4
溶液混合。若要生成BaSO4沉淀,BaCl2溶液的最小浓度为______________。