山东省潍坊市高三4月模拟考试理综化学试卷
下列说法正确的是
| A.淀粉和纤维素的最终水解产物都是葡萄糖,二者互为同分异构体 |
| B.高纯度的二氧化硅是制备光导纤维、太阳能电池板的主要材料 |
| C.石油的分馏、裂化、裂解都属于化学变化 |
| D.合金材料中可能含有非金属元素 |
短周期元素R、T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角。下列判断正确的是
| A.离子半径:T< W<G |
| B.等物质的量的W、G单质分别与足量铁粉反应,后者消耗的铁粉多 |
| C.最简单气态氢化物的热稳定性:Q<R |
| D.T和G组成的化合物溶于水,其水溶液呈中性 |
下列两种物质间发生反应,消耗等物质的量的酸,产生气体最多的是
| A.木炭与浓硝酸 | B.铜与稀硝酸 | C.锌与稀硫酸 | D.木炭与浓硫酸 |
已知 一紫罗兰酮的结构简式是
一紫罗兰酮的结构简式是 ,关于该有机物的说法正确的是
,关于该有机物的说法正确的是
| A.其分子式为C13H18O |
| B.能使溴的四氯化碳溶液、酸性高锰酸钾溶液退色 |
| C.属于芳香族化合物 |
| D.能发生加成反应、取代反应、水解反应 |
下列溶液中有关物质的浓度关系正确的是
A.c(NH4+)相等的NH4HCO3、NH4HSO4、NH4Cl溶液中: |
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中: |
C.1.0mol Na2CO3溶液中: Na2CO3溶液中: |
| D.某二元弱酸的酸式盐NaHA溶液中: |

 kJ
kJ 。在2L恒容密闭容器中各物质的浓度随时间变化的曲线如图所示。下列说法错误的是
。在2L恒容密闭容器中各物质的浓度随时间变化的曲线如图所示。下列说法错误的是
| A.前25min内反应放出的热量为46.lkJ |
| B.第25min改变的条件是将NH3从反应体系中分离出去 |
| C.若第60min时反应又达到了平衡,则时段Ⅲ改变的条件是降低温度 |
| D.若时段I中投入物质的浓度为原来的2倍,则反应物的转化率增大,平衡常数不变 |
钛被誉为“二十一世纪的金属”,用途广泛。按下图所示组成的产业链可以大大提高资源利用率并能减少环境污染。请回答下列问题:
(1)已知中FeTiO3元素的化合价为+3,钛铁矿经氯化法得到四氯化钛的过程中________元素被氧化,每生产1. 9kgTiCl4消耗Cl2在标准状况下的体积为________L。
则金属Mg还原TiCl4制取金属Ti (s)的热化学方程式为___________.
(3)某化学兴趣小组探究外界条件对合成甲醇反应的影响。
①在300℃时,向体积为1L的密闭容器中加入2mol H2和1mol CO,CO和CH3OH(g)的浓度随时间变化如图所示。
则从反应开始到建立平衡,v(H2)为___________ ;
该温度下 的化学平衡常
的化学平衡常
数为___________ 。
。
②在其它条件不变,只改变其中的一个条件,该小组同学
根据实验绘制如下图像,其中与事实相符的是为___________(填
序号)。
(4)电解饱和食盐水是氯碱工业的基础。
①电解饱和食盐水的离子方程式为为___________ 。
②电解时用盐酸控制阳极区溶液的pH在2~3,盐酸的作用为为___________。(用必要的离子方程式和文字说明)
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题。
(1)汽车尾气的大量排放是造成空气污染的重要因素之一,发展燃料电池汽车可以有效地解决上述问题。直接甲醇燃料电池(DMFC)不会产生有害产物,能量转换效率比内燃机要高2~3倍,电池结构如图所示,c处通入的物质为为______,外电路中电子从______到______(填“A”或“B”)移动,写出电池负极的电极反应方程式 
(2)工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是处理铬污染的常用方法。该法用Fe做电极电解含Cr2O72-的酸性废水,电解时,在阴极上有大量气泡生成,并产生Cr(OH)3、Fe(0H)3沉淀。
①反应中,1molCr2O72-完全生成Cr(OH)3沉淀,外电路通过电子的物质的量为_________ mol。
②常温下,Cr(OH)3的溶度积 ,当Cr3+浓度小于10
,当Cr3+浓度小于10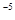 mol
mol 时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。
时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。
(3)含氨废水易引发水体富营养化。向NH4Cl溶液中加入少量NaOH固体,溶液中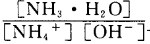 ________(填“增大”“减小”或“不变”);25
________(填“增大”“减小”或“不变”);25 时,NH3•H2O的电离平衡常数
时,NH3•H2O的电离平衡常数 ,该温度下,1mol
,该温度下,1mol 的NH4Cl溶液中
的NH4Cl溶液中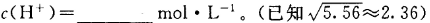
某化学研究小组探究溴化亚铁水溶液与氯气反应。
(1)该小组同学用下图所示装置制取干燥纯净的氯气。
仪器A的名称是________,装置C中的试剂是________,装置F的作用是________;写出制备氯气的离子方程式________。
(2)该小组同学对Cl2与FeBr2溶液的反应进行实验探究。
【实验过程】
向l00mL0. 1mol 的溶液缓缓通入100 mLCl2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl2,溶液黄色加深,变为棕黄色。
的溶液缓缓通入100 mLCl2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl2,溶液黄色加深,变为棕黄色。
【提出假设】上述现象发生的原因可能是:
假设1:Cl2先将Fe2+氧化生成Fe3+,溶液逐渐变黄色,Cl2再把Br-氧化成Br2,溶液变为棕黄色。
假设2:Cl2先将Br-氧化生成Br2,溶液逐渐变黄色,Cl2再把Fe2+氧化成Fe3+,溶液变为棕黄色。
【实验方案】
方案甲:设计实验验证由浅绿色逐渐变黄色的原因________(说明实验操作、现象和结论)。
方案乙:设计对比实验验证氧化性顺序
根据实验得出Cl2、Fe3+、Br2氧化性由强到弱的顺序为________,上述假设合理的是________。
(3)若向含有0.1 molFeBr2的溶液中通人0.1molCl2充分反应,写出反应的离子方程式:________ 。
【化学一物质结构与性质】
根据物质结构与性质的关系,请回答下列问题:
(1)基态铬(Cr)原子的价电子排布式是________,这样排布使整个体系能量最低,原因是________。
(2)氨水中存在多种形式的氢键,其中与“氨极易溶于水”这种性质相关的氢键可表示为:_________。解释NH3分子中键角大于H2O中的键角的原因是_________ 。
(3)下列各项的比较中正确的是_________。
| A.第一电离能:Mg>Al | B.电负性:P>Ge |
| C.稳定性:AsH3>H2S | D.金属性: |
(4) Fe单质的晶体在不同温度下有两种堆积方式,晶胞
结构如图所示,体心立方晶胞和面心立方晶胞中实际含有的
Fe原子个数之比为_________。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号