下列说法正确的是
| A.pH=7的溶液一定是中性溶液 |
| B.能自发进行的化学反应,不一定是△H<0、△S>0 |
| C.白色污染、绿色食品中的“白”“绿”均指相关物质的颜色 |
| D.Ksp不仅与难溶电解质的性质和温度有关,而且与溶液中的离子浓度有关 |
中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是:
| A.用溶解度数据判断煮沸Mg(HCO3)2溶液得到的产物是Mg(OH)2而不是MgCO3 。 |
| B.用pH数据推测不同强酸弱碱盐在水溶液中水解程度的大小。 |
| C.用反应热数据的大小判断不同反应的反应速率的快慢。 |
| D.用平衡常数的大小判断化学反应可能进行的程度。 |
已知:25°C时,Ksp〔Mg(OH)2〕=5.61×10-12,Ksp〔MgF2〕=7.42×10-11。下列说法正确的是
| A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25°C时,Mg(OH)2固体在20mL0.01 mol·L-1氨水中的Ksp比在20mL0.01mol·L-1NH4Cl溶液中的Ksp小 |
| D.25°C时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
已知氯化银在水中存在沉淀溶解平衡:AgCl Ag+ + Cl-,25℃时氯化银的KSP=1.8×10-10。现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是
Ag+ + Cl-,25℃时氯化银的KSP=1.8×10-10。现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是
| A.100mL蒸馏水中 | B.50mL0.1mol?L-1的氯化镁溶液 |
| C.100mL0.1mol?L-1的氯化钠溶液 | D.50mL0.1mol?L-1的氯化铝溶液 |
(1)某温度(t℃)时,测得0.01 mol·L-1 的NaOH溶液的pH=13,请回答下列问题:
①该温度下水的Kw= 。
②此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va︰Vb= 。
(2)已知25°C时Ksp(Mg(OH)2)=1.8×10-11,为除去某食盐溶液中的Mg2+,可用NaOH为除杂试剂,当控制溶液PH=12时,可确保Mg2+除尽,此时溶液中Mg2+的物质的量浓度为 .
在石灰乳中存在平衡体系:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),下列方法中,能使c(Ca2+)减小、c(OH-)增大的是
Ca2+(aq)+2OH-(aq),下列方法中,能使c(Ca2+)减小、c(OH-)增大的是
| A.加入少量MgCl2固体 | B.加入少量Na2CO3固体 |
| C.加入少量KCl固体 | D.加入少量CaO固体 |
根据下图溶解度曲线,在恒定70℃将物质的量浓度相等的硝酸钠溶液和氯化钾溶液等体积混合降温至25℃,首先析出的是
| A.氯化钠 |
| B.硝酸钠 |
| C.氯化钾 |
| D.硝酸钾 |
CrO3和K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去(已知Ksp Fe(OH)3=4.0×10-38,Ksp Cr(OH)3=6.0×10-31)。已知电解后的溶液中c(Fe3+)为4×10-14 mol·L-1,此时溶液的pH(室温下测得)和溶液中c(Cr3+)分别为
| A. 6; 6×10-7 mol·L-1 | B. 7; 1×10-5 mol·L-1 |
| C.7 ; 4×10-8 mol·L-1 | D. 6; 1× 10-5 mol·L-1 |
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备的实验方案:

| 模拟海水中的离子 |
|
|
|
|
|
| 浓度( |
0.439 |
0.050 |
0.011 |
0.560 |
0.001 |
注:溶液中某种离子的浓度小于,可认为该离子不存在;
实验过程中,假设溶液体积不变
下列说法正确的是
| A. |
沉淀物
|
| B. |
溶液
|
| C. |
溶液
|
| D. |
步骤②中若改为加入4.2
|
AgCl固体溶解在水中形成饱和溶液(AgCl固体有剩余),下列说法正确的是 ( )
| A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等 |
| B.在此饱和溶液中加水,KSP(AgCl)增大 |
| C.在此饱和溶液中加浓的Na2S溶液,生成黑色沉淀 |
| D.向AgCl饱和溶液中加入NaCl固体,c(Ag+)不变 |
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是
| A.b点对应的Ksp等于c点对应的Ksp |
| B.采取蒸发溶剂的方法可以使溶液从a点变到b点 |
| C.该温度下,Ag2SO4的溶度积常数(Ksp)为1.6×10-5(mol·L-1)2 |
| D.0.02mol·L-1的AgNO3溶液与的0. 2mol·L-1的Na2SO4溶液等体积混合不会生成沉淀 |
一定温度下,氢氧化镁的悬浊液中存在下列平衡:Mg(OH)2(s) Mg2+(aq)+2OH—(aq),保持温度不变,向其中加入下列物质,可使悬浊液中氢氧化镁固体质量减少的是
Mg2+(aq)+2OH—(aq),保持温度不变,向其中加入下列物质,可使悬浊液中氢氧化镁固体质量减少的是
| A.H2O | B.MgCl2固体 | C.NaOH 固体 | D.NH4C1固体 |
常温下Ca(OH)2溶于水达饱和时存在如下平衡: Ca(OH)2(s) Ca(OH)2(aq),Ca(OH)2(aq)
Ca(OH)2(aq),Ca(OH)2(aq) Ca2++2OH— 饱和石灰水的密度为d g/cm3,溶液的pH=12。则该温度下Ca(OH)2的溶解度为
A.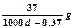 |
B.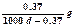 |
C.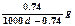 |
D.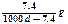 |
有关AgCl沉淀的溶解平衡的说法中,不正确的是( )
| A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等 |
| B.AgCl难溶于水,溶液中没有Ag+和Cl- |
| C.升高温度,AgCl沉淀的溶解度增大 |
| D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度降低 |