下列除杂方法不正确的是
| A.除去NH4Cl溶液中的FeCl3,可向溶液中加入氨水调节pH |
| B.除去金属离子Cu2+、Hg2+,可向溶液中加入Na2S、H2S等沉淀剂 |
| C.除去某溶液中的SO42-可向溶液中加入镁盐 |
| D.除去ZnCl2溶液中的Fe3+可向溶液中加入Zn(OH)2 |
下列叙述正确的是
| A.常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 |
| B.常温下,向AgCl的饱和溶液中加入NaCl固体,有固体析出,且AgCl的Ksp变小 |
| C.在0.1 mol·L-1 CH3COONa溶液中,c(OH-)>c(CH3COOH)+c(H+) |
| D.常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-) |
粗制的CuSO4·5H2O晶体中含有Fe2+。提纯时,为了除去Fe2+,常加入少量H2O2,然后再加入少量碱至溶液pH=4,即可以除去铁离子而不损失硫酸铜。下列说法不正确的是
| A.溶解CuSO4·5H2O晶体时要加入少量稀H2SO4 |
| B.加入H2O2,除Fe2+的离子方程式:2Fe2+ + H2O2 + 4OH- ="=" 2 Fe(OH)3 |
| C.由于CuSO4的催化作用,会使部分H2O2分解而损失 |
| D.调溶液pH=4的依据是当pH=4时Fe(OH)3沉淀完全,而Cu(OH)2还未开始沉淀 |
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示:下列有关Ag2SO4说法正确的是
| A.含有大量SO42-的溶液中肯定不存在Ag+ |
| B.Ag2SO4的溶度积常数(Ksp)为8×10-4 |
| C.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
| D.0.02mol•L-1的AgNO3溶液与0.2mol•L-1的Na2SO4溶液等体积混合不会生成沉淀 |
下列事实中,不能用勒沙特列原理来解释的是
| A.除去CuCl2溶液中的Fe3+,通常是向其中加入CuO、Cu(OH)2等固体 |
B.对于反应H2(g)+I2(g)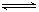 2HI(g),增大平衡体系的压强(压缩体积),可使体系颜色变深 2HI(g),增大平衡体系的压强(压缩体积),可使体系颜色变深 |
| C.AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度 |
| D.在Na2CO3溶液中,由水电离出的c(OH-) >1×10-7mol/L |
下列说法中,正确的是
| A.AgCl 悬浊液中加入 KI 溶液,白色沉淀变成黄色,证明此条件下 Ksp(AgCl)<Ksp(AgI) |
| B.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数 |
| C.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的 pH 会增大 |
| D.强电解质的水溶液中不存在分子 |
请根据所学化学知识回答下列问题:
(1)氯化铁溶液蒸干并灼烧后得到的固体物质的化学式是________。
(2)在浓度均为0.1 mol/L的①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4四种溶液中,NH4+浓度由大到小的顺序为________(用代号表示)。
(3)25时,某浓度的CH3COONa溶液呈碱性的原因是________(用离子方程式表示),溶液中所有离子的浓度由大到小的顺序是________。
(4)某温度下,蒸馏水的pH = 6,氢氧化物R(OH)2的Ksp = 1×10-13,则R2+沉淀完全时,溶液的pH为_______。
已知常温下,AgCl的溶解度大于AgBr的溶解度,将AgCl、AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液发生反应。下列叙述正确的是
| A.只有AgBr沉淀生成 |
| B.AgCl沉淀多于AgBr沉淀 |
| C.AgCl沉淀少于AgBr沉淀 |
| D.AgCl、AgBr沉淀等量生成 |
(共8分)
(1)物质的量浓度相同的①氨水;②氯化铵;⑧碳酸氢铵;④硫酸氢铵;⑤硫酸铵5种溶液中c(NH4+)的大小顺序是______,溶液pH的大小顺序是______。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其 ..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为 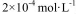 ,则生成沉淀所需CaCl2溶液的最小浓度为 。
,则生成沉淀所需CaCl2溶液的最小浓度为 。
(3)己知: 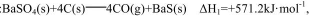

则反应 
在pH为4~5的环境中,Cu2+ 、Fe2+ 不能生成沉淀,而Fe3+几乎完全沉淀。工业上制取CuCl2是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解,欲除去溶液中的杂质离了,下列方法正确的是
| A.加入纯Cu将Fe2+ 还原 |
| B.向溶液中加入(NH4)2S 使Fe2+沉淀 |
| C.直接加水加热使杂质离子水解除去 |
| D.在溶液中通入Cl2,再加入CuO粉末调节pH为4-5 |
下列叙述正确的是
| A.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
B. 的正、逆反应的平衡常数K随温度的变化可用上图表示 的正、逆反应的平衡常数K随温度的变化可用上图表示 |
C. ,常温下该反应一定能自发进行 ,常温下该反应一定能自发进行 |
| D.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小 |
已知Zn(OH)2的溶度积常数为1.2×10-17,则Zn(OH)2在水中物质的量浓度为
| A.1.4×10-6mol·L-1 | B.3.0×10-6mol·L-1 |
| C.1.4×10-9mol·L-1 | D.3.0×10-9mol·L-1 |
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
SO2可使酸性高锰酸钾褪色 |
SO2有漂白性 |
| B |
浓硫酸具有脱水性和强氧化性 |
浓硫酸滴到湿润的蔗糖中,蔗糖变 成黑色海绵状 |
| C |
SiO2有导电性 |
SiO2可用于制备光导纤维 |
| D |
BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀 |
Ksp(BaSO4)<Ksp(BaCO3) |
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是
| A.图中a点对应的是AgBr的不饱和溶液 |
| B.在t℃时,AgBr的Ksp为4.9×10-13 |
| C.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
D.在t℃时,AgCl(s)+Br-(aq)  AgBr(s)+Cl-(aq)平衡常数K≈816 AgBr(s)+Cl-(aq)平衡常数K≈816 |