往含Cl-和I-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示。下列说法正确的是
| A.KSP (AgCl) < KSP (AgI) |
| B.c( Cl- ) :c( I-) =" 3" :2 |
| C.m( AgCl ) :m( AgI ) =" 2" :3 |
| D.a~b段产生黄色沉淀 |
T℃时,CaCO3和CaF2的Ksp分别为1.0 ×10-10。和4.0 ×10-12。下列说法正确的是
| A.T℃时,两饱和溶液中c(Ca2+):CaCO3>CaF2 |
| B.T℃时,两饱和溶液等体积混合,会析出CaF2固体 |
| C.T℃时,CaF2固体在稀盐酸中的Ksp比在纯水中的Ksp大 |
| D.T℃时,向CaCO3悬浊液中加NaF固体,可能析出CaF2固体 |
已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(Ag2CrO4)=2.0×10—12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
| A.AgCl>AgI> Ag2CrO4 | B.AgCl> Ag2CrO4>AgI |
| C.Ag2CrO4>AgCl>AgI | D.Ag2CrO4>AgI>AgCl |
下列说法正确的是
| A.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小 |
| B.根据CO2通入漂白粉水溶液中,溶液先变浑浊后澄清,推断SO2通入也有同样现象 |
| C.向1 mL浓度均为0.05 mol·L-1的NaCl、NaI混合溶液中滴加2滴0.01 mol·L-1的AgNO3溶液,振荡,沉淀呈黄色。结论:Ksp(AgCl)<Ksp(AgI) |
| D.将Fe(NO3)2晶体溶于稀硫酸,滴加KSCN溶液,通过观察溶液变红确定硝酸亚铁晶体已被氧化 |
下列说法中正确的是
| A.常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42-、NH4+能大量共存 |
| B.常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存 |
| C.一定温度下。l L 0.5 mol·L-1NH4C1溶液与2 L 0.25 mol·L-1NH4Cl溶液含NH4+物质的量相同 |
| D.反应ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq)说明Ksp(ZnS)>Ksp(CuS) |
下列化学实验事实及其解释都正确的是
| A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 |
| B.向SO2水溶液中滴加盐酸酸化的Ba(NO3)2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸 |
| C.向0.1mol·L-1FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性 |
| D.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1 AgNO3溶液,振荡,沉淀呈黄色,说明同温度下AgCl的Ksp比AgI的Ksp 大 |
一定温度下,难溶强电解质的饱和溶液中存在着沉淀溶解平衡,其平衡常数为
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| Ksp(25℃) |
8.0×10﹣16 |
2.2×10﹣20 |
4.0×10﹣38 |
对于含Fe2(SO4)3、FeSO4和CuSO4各0.5mol的混合溶液1L,根据上表数据判断,说法错误的是
A.向混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B.向溶液中加入双氧水,并用CuO粉末调节pH,过滤后可获较纯净的CuSO4溶液
C.该溶液中c(SO42﹣):[c(Fe3+)+c(Fe2+)+c(Cu2+)]=5:4
D.将少量FeCl3粉末加入含Cu(OH)2的悬浊液中,其中c(Cu2+)增大
下列说法正确的是
| A.常温下,2NO(g)+O2(g)=2NO2(g)能够自发进行,则该反应的△H<0 |
| B.温度一定时,向水中滴加少量酸或碱形成稀溶液,水的离子积常数Kw不变 |
| C.常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| D.由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 |
下列叙述I和II均正确并有因果关系的是
| 选项 |
叙述I |
叙述II |
| A] |
SO2和氯水都有漂白性 |
二者混合使用漂白效果更好 |
| B |
Ksp(AgCl) >Ksp(AgI) |
AgCl悬浊液中加入KI溶液能产生黄色沉淀 |
| C |
SiO2是酸性氧化物 |
SiO2不与任何酸溶液反应 |
| D |
浓硝酸具有强氧化性 |
应保存在棕色玻璃试剂瓶中 |
下列选项正确的是
| A.CH3COONa溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
| B.向KI溶液中加入氯化银,沉淀逐渐变黄色,说明同温下Ksp(AgI)>Ksp(AgCl) |
| C.向冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
| D.0.1mol/L的KHA溶液,其pH=10,c(K+)>c(A2-)>c(HA-)>c(OH-) |
下列有关电解质溶液中粒子浓度关系正确的是
| A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) |
| C.pH相等的①NH4Cl ②(NH4)2SO4③NH4HSO4溶液中:c(NH4+)大小顺序:①>②>③ |
| D.含等物质的量的NaHC2O4和Na2C2O4的溶液: 3c(Na+)=2[c(HC2O4-)+ c(C2O42-)+c(H2C2O4)] |
常温下,取一定量的PbI2固体配成饱和溶液 ,T时刻改变某一条件,离子的浓度变化如图所示,(注:第一次平衡时c(I-)=2x10-3mol/L, c(Pb2+)=1x10-3mol/L)下列有关说法正确的是
| A.常温下,Ksp=2x10-6 |
| B.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,c(Pb2+)不变 |
| C.T时刻改变的条件是升高温度,PbI2的,Ksp 增大 |
D.常温下Ksp[PbS]=8x10-28,向PbI2的悬浊液中加入Na2S溶液,PbI2(s)+S2-(aq) PbS(s)+2I-(aq)反应的化学平衡常数为5x1018 PbS(s)+2I-(aq)反应的化学平衡常数为5x1018 |
已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.0×10-13。该温度下,下列说法错误的是
| A.AgCl的悬浊液中通入少量HCl,c(Ag+)减小 |
B.AgCl和AgBr共存的悬浊液中, |
| C.AgBr悬浊液中加入足量NaCl可能有AgCl沉淀生成 |
| D.等浓度的NaCl和NaBr混合溶液中滴加AgNO3溶液,先析出AgCl沉淀 |
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是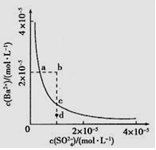
| A.加入Na2SO4可以使溶液由a点变到c点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.b、d点都是不能长时间稳定存在的点 |
| D.a点对应的Ksp大于c点对应的Ksp |