(1)常温下,向某Ba(OH)2溶液中逐滴加入pH=x的盐酸,测得如下数据:
| 序号 |
Ba(OH)2溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
| ① |
22.00 |
0.00 |
12 |
| ② |
22.00 |
18.00 |
11 |
| ③ |
22.00 |
22.00 |
7 |
x= ____________ ;Ba(OH)2溶液的物质的量浓度为____
(2)常温下,向100mL pH=2的硫酸与硫酸钠的混合溶液中,加入300mL上述Ba(OH)2溶液,沉淀正好达最大量,此时溶液的pH ______7(填“>”“<” 或“=”);原混合溶液中硫酸钠的物质的量浓度为
某种工业废水中含有一定量的Cr2O72-和CrO42-,它们易被人体吸收积累而导致肝癌。污水处理厂常用还原沉淀法处理含铬废水,其流程如下: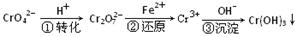
(1)已知第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
①Cr2O72-中Cr的化合价是 。
②若平衡体系的pH=10,则溶液显 色。
(2)第②步发生反应的离子方程式为 _______ ,还原1mol Cr2O72—离子,需要_______mol的FeSO4·7H2O;
(3)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列说法正确的是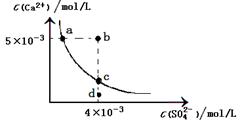
| A.CaSO4在稀硫酸中的溶解性与在纯水中的溶解性相同 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L |
| C.d点溶液通过蒸发可以变到c点 |
| D.a点对应的Ksp等于c点对应的Ksp |
工业品MnCl2溶液中含有Cu2+、Pb2+等离子,加入过量难溶电解质MnS,可使Cu2+、Pb2+等离子形成沉淀,以制取纯净MnCl2。由此可推知MnS
| A.具有吸附性 | B.溶解度小于CuS、PbS |
| C.溶解度与CuS、PbS相同 | D.溶解度大于CuS、PbS |
常温下,0.1 mol·L-1某一元酸(HA)溶液中 =1×10-8,下列叙述正确的是( )
=1×10-8,下列叙述正确的是( )
A.溶液中水电离出的c(H+)=10-10 mol·L-1
B.溶液中c(H+)+c(A-)=0.1 mol·L-1
C.与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中离子浓度大小关系为:c(A-)>c(Na+)>c(OH-)>c(H+)
D.上述溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
在25℃时,有pH为a的HCl溶液和pH为b的NaOH溶液,取VaL该盐酸溶液用该NaOH溶液中和,需VbL NaOH溶液,(题中 a < b, b ≥ 8)。问:
(1)若a+b=14,则Va/Vb= .
(2)若a+b=13,则Va/Vb=
(3)若a+b>14,则Va/Vb= ,且Va Vb(填“>”“<”“=”)
高温下,某反应达平衡,平衡常数K= .恒容时,温度升高,H2浓度减小。下列说法正确的是
.恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
| D.该反应化学方程式为CO+H2O=CO2+H2 |
25℃时,5种银盐的溶度积常数(Ksp)分别是:
| AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
| 1.8×10-10 |
1.4×10-5 |
6.3×10-50 |
7.7×10-13 |
8.51×10-16 |
下列说法正确的是
A.氯化银、溴化银和碘化银的溶解度依次增大
B.将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不能得到黑色沉淀
C.在5mL1.8×10-5 mol/L的NaCl溶液中,加入1滴(1mL约20滴)0.1 mol/L的AgNO3溶液,不能观察到白色沉淀
D.将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成
重晶石(主要成分是BaSO4)是制备钡化合物的重要原料,但BaSO4不溶于水也不溶于酸,这给转化为其他钡盐带来了困难,工业上用饱和Na2CO3溶液处理BaSO4沉淀,待达到平衡后,移走上层清夜,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐。
Ksp(BaSO4)=1.0×10-10 Ksp(BaCO3)=5.0×10-10
(1)写出沉淀转化的方程式: ,此反应平衡常数K的值为 。
(2)要实现该转化C(CO32-)不低于 mol/L
(3)必须更换Na2CO3溶液的原因是什么?
已知某温度下,Ksp(AgCl)=1.56×10-10 mol2·L-2,Ksp(Ag2CrO4)=1×10-12 mol3·L-3,下列叙述正确的是
| A.饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 |
| B.向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 |
| C.向0.0008 mol·L- 1的K2CrO4溶液中加入等体积的0.002 mol/L AgNO3 溶液,则CrO42-完全沉淀 |
| D.将0.001 mol·L- 1的AgNO3 溶液滴入0.001 mol·L- 1的KCl和0.001 mol·L- 1的K2CrO4溶液,则先产生AgCl沉淀 |
定量分析中可用AgNO3溶液滴定Cl-溶液,加入K2CrO4为指示剂,达到滴定终点时溶液体积为50mL,c(Cl-) = 10-5 mol·L-1,AgNO3与CrO42- 生成砖红色的Ag2CrO4沉淀。已知Ksp(AgCl) = 1.77×10-10,Ksp(AgI) = 8.51×10-17,Ksp(Ag2CrO4) = 1.12×10-12,根据以上实验操作和有关数据,下列说法正确的是
| A.常温下,向含AgCl固体的AgCl溶液中加入NaCl固体,AgCl沉淀的量不变 |
| B.滴定终点时,溶液中CrO42-的浓度约为3.6×10-3 mol·L-1 |
| C.向10mL0.1moL/L AgNO3溶液中滴加3—5滴0.1moL/L NaCl溶液生成AgCl沉淀,再滴加KI溶液,生成AgI沉淀,能够说明Ksp(AgI)< Ksp(AgCl) |
| D.可用0.1 mol·L-1的KI溶液代替K2CrO4做指示剂 |
某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡后,金属阳离子浓度随溶液 的变化如下图所示。下列判断正确的是( )
的变化如下图所示。下列判断正确的是( ) 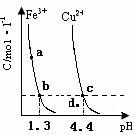
A.加适量浓NH3·H2O可使溶液由 点变到 点变到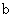 点 点 |
B.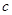  两点代表的溶液中 两点代表的溶液中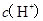 与 与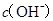 乘积不相等 乘积不相等 |
C.Cu(OH)2在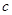 点比在d点代表的溶液中溶解程度小 点比在d点代表的溶液中溶解程度小 |
D.该温度下,氢氧化铁的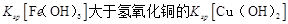 |
甲醇是新型的汽车动力燃料。工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为:2H2(g)+CO(g) CH3OH(g)
CH3OH(g) 
(1)已知:



1 mol甲醇气体完全燃烧生成CO 和水蒸气的热化学方程式为 。
和水蒸气的热化学方程式为 。
(2)下列措施中有利于提高2H2(g)+CO(g) CH3OH(g)反应速率的是 (双选)。
CH3OH(g)反应速率的是 (双选)。
| A.分离出CH3OH | B.升高温度 | C.减小压强 | D.加入合适的催化剂 |
(3)(3)用H2和CO化合制备甲醇的反应中,若反应的容积为1L的恒容容器,分别在230℃、250℃和270℃下,改变H2和CO的起始组成比(起始时CO的物质的量固定为1mol)进行实验,结果如下图所示(图中曲线上的点都为一定温度下、一定组成下的平衡点):
①曲线X对应的温度是 。
②从图中可以得出的结论有 (任写一条)。
(4)若往反应的容积中加入1.5molH2和1.0molCO,在曲线Z对应温度下反应达平衡。利用上述图中a点对应的CO平衡转化率,计算2H2(g)+CO(g) CH3OH(g)的平衡常数。(写出计算过程)
CH3OH(g)的平衡常数。(写出计算过程)
25℃时,1L 0.01mol/LHCl溶液,水的离子积常数Kw为 ,溶液中H+的物质的量浓度为 ,水电离出的H+的物质的量浓度为 ,向上述溶液中加入1L 0.008mol/L的NaOH溶液,反应后溶液的pH为 。
10分)(1)某温度(t ℃)时,水得到KW=10-13,则该温度______25℃,(填“<”“>”或“=”),将此温度下pH=1的硫酸溶液aL与pH=12的氢氧化钠溶液bL混合。若所得混合液为中性,则a:b= ;
(2)下列溶液,c(H+)由小到大的排列顺序是_________,pH由小到大排列顺序是________;(填序号) ①0.1 mol/LHCl溶液 ②0.1 mol/LH2SO4溶液 ③0.1 mol/LNaOH溶液
④0.1 mol/LCH3COOH溶液
(3)对于Ag2S(s)  2Ag+(aq)+ S2-(aq),其Ksp=____________。
2Ag+(aq)+ S2-(aq),其Ksp=____________。