在100mL 0.01mol/L KCl 溶液中,加入 1mL 0.01mol/L AgNO3溶液,下列说法正确的是(AgCl Ksp=1.8×10-10)
| A.有AgCl沉淀析出 | B.无AgCl沉淀 |
| C.无法确定 | D.有沉淀但不是AgCl |
下列有关沉淀溶解平衡的说法正确的是
A.Ksp (AB2)小于Ksp (CD),则AB2的溶解度小于CD的溶解度
B.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,AgCl的Ksp增大
C.在AgI的沉淀溶解平衡体系中,加入K2S固体,AgI沉淀可转化为Ag2S沉淀
D.在CaCO3的沉淀溶解平衡体系中,通入CO2气体,溶解平衡不移动
下列有关说法正确的是
| A.AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 |
| B.反应Hg(1)+H2SO4(aq) = HgSO4(aq)+H2(g)在常温下不能自发进行,则△H>0 |
| C.将纯水加热至较高温度,K变大、pH变小、呈酸性 |
| D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 |
Mg(OH)2在下列四种情况下,其溶解度最大的是
| A.在纯水中 |
| B.在0.1 mol·L-1的CH3COOH溶液中 |
| C.在0.1 mol·L-1的NH3·H2O溶液中 |
| D.在0.1 mol·L-1的MgCl2溶液中 |
在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2(s)  Ca(OH)2(aq)
Ca(OH)2(aq)  Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是( )
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是( )
| A.n(Ca2+)增大 | B.c(Ca2+)不变 |
| C.n(OH-)增大 | D.c(OH-)减小 |
向5mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色。根据上述变化过程,分析此三种沉淀物的溶解度关系为( )
| A.AgCl=AgI=Ag2S | B.AgCl<AgI< Ag2S |
| C.AgCl>AgI> Ag2S | D.AgI>AgCI> Ag2S |
向含有AgCl(s)的饱和AgCl溶液中加水,下列叙述正确的是( )
| A.AgCl的溶解度增大 | B.AgCl的溶解度、Ksp均不变 |
| C.Ksp(AgCl)增大 | D.AgCl的溶解度、Ksp均增大 |
欲增加Mg(OH)2在水中的溶解度,可采用的方法是
| A.增加溶液pH | B.加入2.0 mol·L-1NH4Cl |
| C.加入0.1 mol·L-1MgSO4 | D.加入适量95%乙醇 |
T℃时,CaCO3和CaF2的Ksp分别为1.0 ×10-10。和4.0 ×10-12。下列说法正确的是
| A.T℃时,两饱和溶液中c(Ca2+ ):CaCO3>CaF2 |
| B.T℃时,两饱和溶液等体积混合,会析出CaF2固体 |
| C.T℃时,CaF2固体在稀盐酸中的Ksp比在纯水中的Ksp大 |
| D.T℃时,向CaCO3悬浊液中加NaF固体,可能析出CaF2固体 |
某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:
①5 mL水
②20 mL 0.5 mol·L-1的Na2SO4溶液
③40 mL 0.2 mol·L-1的Ba(OH)2溶液
④40 mL 0.1 mol·L-1的H2SO4溶液中,溶解至饱和
以上各溶液中,c(Ba2+)的大小顺序正确的是( )
| A.③>①>④>② | B.③>①>②>④ |
| C.①>④>③>② | D.①>③>④>② |
下列说法正确的是
| A.在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS) |
| B.在NaHS溶液中,加入少量CuCl2粉末产生黑色沉淀,则pH增大 |
| C.加热条件下并加入大量水促进TiCl4水解,以制备TiO2固体 |
| D.铜制器皿放置过程中会生成铜绿是因为发生了析氢腐蚀 |
化学平衡常数(K)、电离常数(Ka)、溶度积常数(Ksp)是判断物质性质或变化的重要的常数。下列关于这些常数的说法中,正确的是( )
| A.化学平衡常数的大小与温度、浓度、压强、催化剂有关 |
| B.CH3COONH4溶液几乎呈中性,说明Ka(CH3COOH)与Kb(NH3·H2O)近似相等 |
| C.Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-=AgI(s)+Cl-能够发生 |
| D.Ka(HCN)<Ka(CH3COOH),说明相同浓度时,氢氰酸的酸性比醋酸强 |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
(2)CuSO4+Na2S: Cu2++S2-=CuS↓
下列几种物质的溶解度大小的比较中,正确的是
| A.CuS<Cu(OH)2<CuCO3 | B.CuCO3<Cu(OH)2<CuS |
| C.CuS<CuCO3<Cu(OH)2 | D.Cu(OH)2<CuCO3<CuS |
一定温度下,在氢氧化钙的悬浊液中,存在氢氧化钙固体与其电离出的离子间溶解结晶平衡:Ca(OH)2(s) 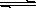 Ca2+(aq)+2OHˉ(aq)。向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度。下列叙述正确的是
Ca2+(aq)+2OHˉ(aq)。向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度。下列叙述正确的是
| A.溶液中钙离子数目减小 | B.溶液中钙离子浓度减少 |
| C.溶液中氢氧根离子浓度增大 | D.pH减小 |
已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol·L-1Na2SO4溶液,针对此过程的下列叙述正确的是( )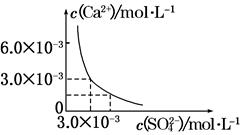
| A.溶液中析出CaSO4沉淀,最终溶液中c(SO42—)较原来的大 |
| B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42—)都变小 |
| C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42—)都变小 |
| D.溶液中无沉淀析出,但最终溶液中c(SO42—)较原来的大 |