向2L密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g)⇌E(g)当反应进行到4min时,测知M的浓度为0.2mol/L;反应进行到2min时,密闭容器中M的物质的量浓度为( )
| A.等于0.6mol/L | B.小于0.6mol/L | C.等于0.8mol/L | D.大于0.8mol/L |
下列有关化学反应速率的说法中,正确的是( )
| A.100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B.用铁片和稀硫酸反应制取氢气,改用铁片和浓硫酸可以加快产生氢气的速率 |
| C.在做草酸与高锰酸钾的反应时,加入少量硫酸锰固体可加快溶液褪色速率 |
| D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,为了加快反应速率,实际生活中使用了增大压强或升高温度的方法 |
为了探究锌与稀硫酸的反应速率[以V(H2)表示],向反应混合液中加入某些物质,下列判断正确的是
| A.加入少量水,v(H2)不变 |
| B.加入CH3COONa固体,v(H2)减小 |
| C.加入NH4HSO4固体,v(H2)不变 |
| D.滴加少量CuSO4溶液,v(H2)减小 |
(1)在一定条件,可逆反应:mA+nB pC达到平衡状态。
pC达到平衡状态。
①若A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡向______(填“正”或“逆”)反应方向移动。
②若A、B、C均为气体,且m+n<p,加热后,可使混合气体平均摩尔质量增加,则正反应是______(填“吸热”或“放热”)反应。
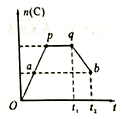
③若在反应过程中,C的物质的量n(C)随时间的变化关系如右图所示(从t1时间开始对反应体系升高温度)。则a、b两点的正反应速率:v(a)______v(b)(填“>”、“<”或“=”);
(2)Na2CO3溶液呈碱性,其原因是(用离子方程式表示)___________________;由同浓度的Na2CO3和NaHCO3组成的混合溶液中离子浓度由大到小的顺序为____________________;
(3)某温度下,纯水的c(H+)=3×10-7mol/L,Na2S和NaOH两溶液的pH均为12,则两溶液中由水电离出的c(OH-)的比值为_________________;
(4)下列事实一定能说明HF是弱酸的是__________;
①常温下NaF溶液的pH大于7 ②常温下0.1mol/L的HF溶液pH=2.3
③HF能与Na2CO3溶液反应,产生CO2气体 ④1mol/L的HF水溶液能使紫色石蕊试液变红
少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入几滴浓硫酸 ④加CH3COONa固体 ⑤加NaCl溶液⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
| A.①⑥⑦ | B.③⑤⑧ | C.③⑦⑧ | D.⑤⑦⑧ |
为探究Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是( )
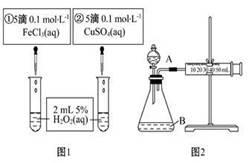
| A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小 |
| B.若图1所示的实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 |
| C.用图2装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时间 |
| D.为检查图2装置的气密性,可关闭分液漏斗A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原 |
(1)已知Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为10 mL):
| 实验编号 |
实验温度/℃ |
c(Na2S2O3)/ (mol·L-1) |
c(H2SO4)/ (mol·L-1) |
| ① |
25 |
0.1 |
0.1 |
| ② |
25 |
0.2 |
0.1 |
| ③ |
25 |
0.1 |
0.2 |
| ④ |
50 |
0.2 |
0.1 |
| ⑤ |
50 |
0.1 |
0.1 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验__________________(填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究______________________对化学反应速率的影响。
(2)已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久反应速率明显增大,溶液很快褪色。
针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是_______________________________的影响。
若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以选择在反应开始前是否加入________(填字母序号)做对比实验。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
设C+CO2 2CO △H>0反应速率为V1,N2+3H2
2CO △H>0反应速率为V1,N2+3H2 2NH3△H<0 反应速率为V2,对于上述反应,当温度升高时,V1和V2的变化情况为( )
2NH3△H<0 反应速率为V2,对于上述反应,当温度升高时,V1和V2的变化情况为( )
| A.同时增大 | B.同时减小 | C.V1增大,V2减小 | D.V1减小,V2增大 |
下列说法正确的是( )
| A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增多 |
| B.有气体参加的反应,若增大压强,可增大活化分子的百分数,从而使反应速率增大 |
| C.升高温度能使反应速率增大的主要原因是减小了反应物分子中活化分子的百分数 |
| D.催化剂能增大活化分子的百分数,从而成千上万倍地增大反应速率 |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
| A.①② | B.②④⑥ | C.②③⑤ | D.②④⑤⑥ |
下列有关化学反应速率的说法正确的是
| A.用铁片和稀硫酸反应制氢气时,可改用98%的浓硫酸加快生成氢气速率 |
| B.100 mL 2 mol·L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
| C.汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 |
| D.SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢 |
下列说法不正确的是
A.比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加 溶液,观察铁钉周围出现蓝色沉淀的快慢 溶液,观察铁钉周围出现蓝色沉淀的快慢 |
| B.探究温度对化学反应速率影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 |
| C.欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(试纸)为:中和滴定实验、pH试纸 |
| D.从海带中提取碘,可将灰化后的海带加入水中煮沸一段时间后过滤,向滤液中滴入几滴硫酸,再加入适量H2O2溶液氧化,最后加入CCl4萃取分离 |
已知分解1mol H2O2放出热量98kJ。在含有少量I-的溶液中,H2O2分解的机理为:
H2O2+ I-→H2O+IO- 慢 H2O2+ IO-→H2O+O2+ I- 快
下列有关该反应的说法正确的是
| A.反应速率与I-浓度有关 | B.IO-也是该反应的催化剂 |
| C.反应活化能等于98kJ/mol | D.v(H2O2)=v(H2O)=v(O2) |
该同学用如下装置进行实验,分析影响反应速率的因素。实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示。
| 实验Ⅰ(断开K)1分钟水滴数 |
34 |
59 |
86 |
117 |
… |
102 |
| 实验Ⅱ(闭合K)1分钟水滴数 |
58 |
81 |
112 |
139 |
… |
78 |

下列说法不正确的是
A.实验Ⅰ中化学能主要转化为热能
B.实验Ⅱ中化学能主要转化为电能
C.反应前期水滴数58>34、81>59,主要原因是实验Ⅱ中形成原电池加快反应速率
D.反应后期水滴数102>78,主要原因是实验Ⅰ溶液温度高于实验Ⅱ