下列说法中正确的说法有几个 ( )
①活化分子间的碰撞一定能发生化学反应 ②普通分子间的碰撞有时也能发生化学反应 ③增大反应物浓度,可增大活化分子百分数,从而使有效碰撞次数增多 ④有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 ⑤化学反应的实质是旧化学键断裂和新化学键形成的过程 ⑥催化剂能增大活化分子百分数,从而成千成万倍地增大化学反应速率
| A.1个 | B.2个 | C.3个 | D.4个 |
反应C(s)+H2O(g) CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A.加入少量的C(s)粉 | B.将C(s)粉碎成细小粉末 |
| C.体积可变,充入氩气 | D.保持体积不变,充入氢气 |
在一定温度下的可逆反应:mA(g)+nB(g) pC(g)+qD(g),生成物C的体积分数与压强p1和p2,时间t1和t2的关系如图所示,则在下列关系中正确的是
pC(g)+qD(g),生成物C的体积分数与压强p1和p2,时间t1和t2的关系如图所示,则在下列关系中正确的是
| A.p1>p2 | B.反应吸热 |
| C.m+n>p+q | D.m+n<p+q |
下列说法不正确的是
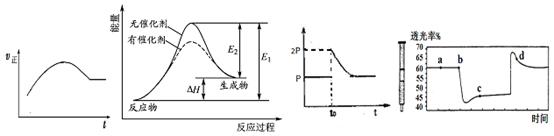
甲 乙 丙 丁
A.绝热恒容密闭容器中通入A和B,发生反应:2A (g)+B (g)  2C(g),图甲为其正反应速率随时间变化的示意图,则该反应为放热反应。 2C(g),图甲为其正反应速率随时间变化的示意图,则该反应为放热反应。 |
| B.催化剂能降低反应的活化能,提高活化分子的百分含量,从而加快化学反应速率。图乙显示的是催化反应与无催化反应过程中的能量关系。 |
C.将BaO2放入密闭真空容器中,反应2BaO2(s)  2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图丙所示。 2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图丙所示。 |
D.将一定量的NO2充入针筒中后封口,发生反应2NO2 (g) N2O4(g),图丁表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。则c点与a点相比,c(NO2)增大,c(N2O4)减小。 N2O4(g),图丁表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。则c点与a点相比,c(NO2)增大,c(N2O4)减小。 |
如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2 mol X和2 mol Y,开始时容器的体积均为V L,发生如下反应并达到平衡状态: 2X(?)+Y(?) aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是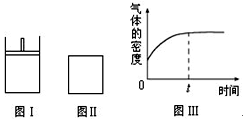
| A.物质Z的化学计量数a = 2 |
| B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态 |
| C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ﹤Ⅱ |
| D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ |
下列说法正确的是
| A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 |
| B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 |
| C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 |
| D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
“低碳循环”引起了全世界的高度重视,减排CO2的一种方法是:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
(1)500℃时有容积为2L的密闭容器中充入2mol CO2和6mol H2,测得CO2和CH3OH的物质的量随时间变化如图所示。

①反应的ΔS (填“>”或“<”)0,从反应开始到平衡,H2的平均反应速率:
υ(H2)=__________mol/(L·s)。
②该反应的平衡常数K=__________(保留二位有效数字);平衡时H2的转化率为________。
③将上述平衡体系的温度升高至700℃,平衡常数K=5.01,则ΔH 0(填“>”或“<”或“﹦”);为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有 __________(填序号)。
a.升高温度 b.缩小容器的容积 c.使用合适的催化剂 d.再充入CO2气体
(2)已知:①H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1
③2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1257.5 kJ·mol-1
写出液态甲醇不完全燃烧生成CO气体和液态H2O的热化学方程式:
过量的锌粉与10 mL 浓度为1 mol ·L-1的盐酸反应,若加入适量的下列溶液,能减慢反应速率但不影响氢气生成量的是
| A.CH3COOH | B.CuSO4 | C.K2SO4 | D.NaHCO3 |
下列说法不正确的是
| A.探究温度对反应速率影响时,分别水浴加热硫代硫酸钠溶液、硫酸溶液到一定温度,再将两溶液混合 |
| B.H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 |
| C.用简易量热计测定反应热,使用碎泡沫隔热保温、环形玻璃搅拌棒搅拌、量取达到的最高温度,计算反应热,取2~3 次的实验平均值 |
| D.取皂化反应后的混合液滴入热水中,观察现象,可判断皂化反应是否完全 |
用铁片与稀硫酸反应制氢气时,下列措施不能使氢气生成速率加快的是
| A.加热 |
| B.不用稀硫酸,改用98%浓硫酸 |
| C.加CuSO4溶液 |
| D.不用铁片,改用铁粉 |
某化学兴趣小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H2C2O4 + 3H2SO4 ="=" K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
| 实验编号 |
室温下,试管中所加试剂及其用量 / mL |
室温下溶液颜色褪至无色所需时间 / min |
|||
| 0.6 mol/L H2C2O4溶液 |
H2O |
0.2 mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
||
| 1 |
3.0 |
2.0 |
3.0 |
2.0 |
4.0 |
| 2 |
3.0 |
3.0 |
2.0 |
2.0 |
5.2 |
| 3 |
3.0 |
4.0 |
1.0 |
2.0 |
6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是 。
(2)利用实验1数据计算,用KMnO4的浓度变化表示反应速率  (KMnO4) = 。
(KMnO4) = 。
(3)该小组同学根据经验绘制了 (Mn2+) 随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中
(Mn2+) 随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中 (Mn2+) 随时间变化的趋势应如图乙所示。 该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。
(Mn2+) 随时间变化的趋势应如图乙所示。 该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。


①该小组同学提出的假设是 。
②请你帮助该小组同学完成实验方案,并选择表中空白处应加入的物质。
| 实验编号 |
室温下,试管中所加试剂及其用量 / mL |
再向试管中加入少量固体 |
室温下溶液颜色褪至无色所需时间 / min |
|||
| 0.6 mol/L H2C2O4溶液 |
H2O |
0.2 mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
|||
| 4 |
3.0 |
2.0 |
3.0 |
2.0 |
|
 |
A.KMnO4 B.H2C2O4 C.K2SO4 D.MnSO4
③若该小组同学提出的假设成立,应观察到的现象是 。
一定条件下,分别对反应C(s)+CO2(g)  2CO(g)(ΔH>0)进行如下操作(只改变该条件):①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应速率显著变大的是
2CO(g)(ΔH>0)进行如下操作(只改变该条件):①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应速率显著变大的是
| A.①②③④ | B.①③④ | C.①② | D.①③ |
“碘钟”实验中,3I-+S2O82-===I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| c(I-)/(mol·L-1) |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
| c(S2O82-)/(mol·L-1) |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
| t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该实验的目的是_________________________________________________。
(2)显色时间t2=________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t3的范围为____(填字母)。
A.<22.0 s
B.22.0~44.0 s
C.>44.0 s
D.数据不足,无法判断
右图曲线a表示放热反应X(g) + Y(g)  Z(g) + M(g) + N(s) △H <0进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g) + M(g) + N(s) △H <0进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是

| A.升高温度 | B.加大X的投入量 |
| C.加催化剂 | D.增大体积 |